
科目: 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )
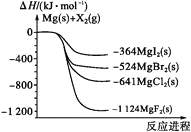
A. 由MgCl2制取Mg是放热过程
B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
C. 常温下氧化性:F2<Cl2<Br2<I2
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s) + Cl2(g) ═ MgCl2(s) + Br2(g) △H = -117kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某甲酸溶液中含有甲醛,用下列方法可以证明的是
A.加入足量的新制氢氧化铜并加热煮沸,有砖红色的沉淀
B.加入过量的氢氧化钠充分反应后的溶液能发生银镜反应
C.将试液进行酯化反应后的混合液能发生银镜反应
D.加入足量氢氧化钠后,蒸馏出的气体通入新制的氢氧化铜悬浊液加热有砖红色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】石墨烯是只由一层碳原子所构成的平面薄膜,其结构模型见如图。有关说法错误的是( )

A.晶体中碳原子键全部是碳碳单键
B.石墨烯与金刚石都是碳的同素异形体
C.石墨烯中所有碳原子可以处于同一个平面
D.从石墨中剥离得到石墨烯需克服分子间作用力
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是

A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe2e =Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e=H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。有关说法正确的是( )
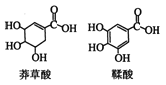
A.等浓度的两种酸其酸性相同
B.两种酸都能与溴水发生加成反应
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.鞣酸能与Fe3+发生显色反应,而莽草酸不能
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一个电化学原理的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。填写下列空白:
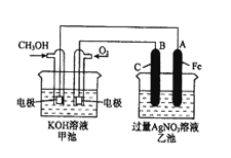
(1)请写出甲、乙两池的名称。甲电池是______,乙池是______。
(2)甲池中通入CH3OH的电极名称是___,电极反应方程式为:______;乙池中B(石墨)电极的名称是_______。
(3)电解过程中,乙池溶液pH的变化为_______(“升高”、“降低”或“不变”)。
(4)当乙池中A(Fe)极的质量增加5.40 g时,甲池中理论上消耗O2_____mL(标准状况下)。
(5)若乙池中的AgNO3换成一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为___mol。(忽略溶液体积的变化)
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃,几种物质的pH和浓度如下表所示。回答下列问题:
序号 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH | 11 | 11 | 3 | 3 |
浓度 | c1 | c2 | c3 | c4 |
(1)c1____(填“>”“<”或“=”)c2。
(2)溶液中水的电离程度②____(填“>”“<”或“=”)③。
(3)分别加水稀释10倍,稀释后四种溶液的pH由大到小的顺序为____(填序号)。
(4)①溶液与④溶液等体积混合,溶液的pH____7(填“>”“<“或“=”),用④溶液滴定①溶液,滴定过程中不可能出现的结果是____。
A. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B. c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C. c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D. c(Cl-)>c(NH4+)>c(H+)>c(OH-)
E. c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(5)氢氧化铜悬浊液中有如下平衡:Cu(OH)2(s)![]() Cu2+(aq)+2OH-(aq),常温下,Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液使之pH>_____。
Cu2+(aq)+2OH-(aq),常温下,Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液使之pH>_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:①反应I:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
②H2(g)+![]() O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)═H2O(g) ΔH3=+44.0 kJ·mol-1
则反应2NH3(g)![]() N2(g)+3H2(g)的反应热△H=___。
N2(g)+3H2(g)的反应热△H=___。
(2)合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |

①△H2_____(填“>”“<”或“=”)0。
②下列说法正确的是_______(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③03min内用CH3OH表示的反应速率v(CH3OH)=___(保留三位小数)。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡__(填“正向”、“逆向”或“不”)移动。
(3)体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。
(1)某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸____________mL(保留两位小数)。
(2)某溶液组成如表一:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 814.8 | 400.3 | 97.3 |
问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 137.7 | 428.8 | 97.3 |
计算析出的碳酸氢钠晶体的质量(保留1位小数)。____________
(3)将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留1位小数)。____________
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式____________
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(Ⅰ)、氨水]吸收在生产过程中产生的CO和CO2等气体,铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac。
[Cu(NH3)3CO]Ac。
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是___。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式:___。
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___,其中氮元素原子最外层电子排布的轨道表示式是___,通过比较___可判断氮、磷两种元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是___。
(5)CS2熔点高于CO2,其原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com