
科目: 来源: 题型:
【题目】四种短周期元素X、Y、Z、W的最外层电子数之和为16,其中X、Y、Z的电子层数相同,W原子的核外电子层数与其他三种不同,X元素的焰色反应呈黄色,Y元素能形成多种单质,其中一种单质在空气中易自燃,Z元素的最外层电子数是K层的2倍。下列推断正确的是( )
A.原子半径:X<Y
B.简单离子半径:W>X>Y
C.Z和W形成的化合物和某些酸、强碱均能发生反应
D.X、Y、W和氢元素形成的化合物的水溶液一定呈碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】对已达化学平衡的反应:2X(g)+Y(g)![]() 2Z(g),减小压强后,对反应产生的影响是
2Z(g),减小压强后,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正反应速率先减小后增大,逆反应速率减小,平衡向逆反应方向移动
D.逆反应速率先减小后增大,正反应速率减小,平衡向逆反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时将10mLpH=11的氨水加水稀释至100mL,下列判断正确的是
A.稀释后溶液的pH=7B.氨水的电离度增大,溶液中所有离子的浓度均减小
C.稀释过程中![]() 增大D.pH = 11氨水的浓度为0.001mol/L
增大D.pH = 11氨水的浓度为0.001mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】由下列实验及现象推出的相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液 | 滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝 | KI溶液和FeCl3溶液发生反应:2Fe3++2I- |
B | 向稀硫酸中加入铜片,然后通入氧气加热 | 先无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸>Cu2+ |
C | 向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞 | Na2SiO3溶液红色更深 | 非金属性:Si<S |
D | 将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中 | 只产生红褐色沉淀 | Ksp[Al(OH)3]>K sp[Fe(OH)3] |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】NH5属于离子晶体。与水反应的化学方程式为:NH5+H2O→NH3H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。有关NH5叙述正确的是( )
A.与乙醇反应时,NH5被氧化
B.NH5中N元素的化合价为+5价
C.1molNH5中含有5molN-H键
D.1molNH5与H2O完全反应,转移电子2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】贝诺酯临床主要用于治疗类风湿性关节炎、感冒发烧等。合成路线如下:
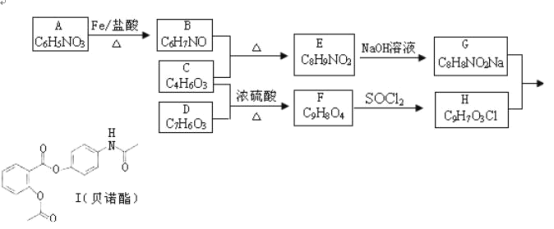
(1)贝诺酯的分子式______。
(2)A→B的反应类型是______;G+H→I的反应类型是______。
(3)写出化合物C、G的结构简式:C______,G______。
(4)写出满足下列条件的F同分异构体的结构简式(任写3种)______。
a.不能与FeCl3溶液发生显色反应;
b.能发生银镜反应和水解反应;
c.能与金属钠反应放出H2;
d.苯环上的一氯取代产物只有两种结构
(5)根据题给信息,设计从A和乙酸出发合成![]() 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)_______________
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
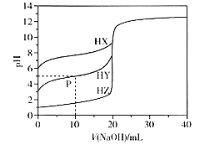
A.电离常数Ka(HX)的数量级为10-12
B.P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
C.pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D.HX的电离程度大于X-的水解程度
查看答案和解析>>
科目: 来源: 题型:
【题目】1-乙氧基萘常用作香料,也可合成其他香料。实验室制备1-乙氧基萘的过程如下:
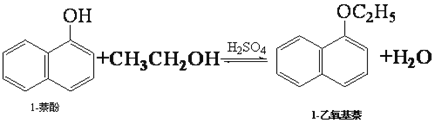
已知:1-萘酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数:
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醇 | |||||
1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
(1)将72g 1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是________。
(2)装置中长玻璃管的作用是:______________。
(3)该反应能否用实验室制备乙酸乙酯的装置_____(选填“能”或“不能”),简述理由_____________。
(4)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是____________(选填编号)。
a.③②④① b.①②③④ c.②①③④
(5)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高,1-乙氧基萘的产量下降可能的两个原因是____________。

(6)提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知2molH2完全燃烧生成水蒸气放出热量484kJ,且1molH-H键断裂时吸收热量为436kJ,1molO=O键断裂时吸收热量为496kJ,则水蒸气中1molH-O键形成时放出的热量为_____。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g) === H2O(l) ΔH1= —Q1 kJ/mol
C2H5OH(g) === C2H5OH(l) ΔH2= —Q2 kJ/mol
C2H5OH(g) + 3O2(g) === 2CO2(g) +3H2O(g) ΔH3= —Q3 kJ/mol
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷及部分重要化合物的相互转化如图所示。
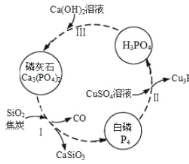
(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为______。
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有______。
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
成分 | CaO | P2O5 | SO3 | CO2 |
质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(3)磷灰石中,碳元素的质量分数为______%(保留两位小数)。
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4______g(保留两位小数)。
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com