
科目: 来源: 题型:
【题目】Cl2及其化合物在生产、生活中具有广泛的用途.将氯气溶于水能形成氯气﹣氯水体系.
完成下列填空:
(1)氯原子最外层电子的电子排布式是__.与电子排布式相比,轨道表示式增加了对核外电子运动状态中__描述.
(2)氢、氯、氧三种元素各能形成一种简单阴离子,按离子半径由大到小的顺序排列这些离子__.
(3)氯气﹣氯水体系中,存在多个含氯元素的平衡关系,请分别用平衡方程式表示:__.已知HClO的杀菌能力比ClO﹣强,氯处理饮用水时,在夏季的杀菌效果比在冬季差,可能原因是__(一种原因即可).
(4)在氯水中,下列关系正确的是__(选填编号).
a c(HClO)+c(ClO﹣)=c(H+)﹣c(OH﹣)
b c(H+)=c(ClO﹣)+c(Cl﹣)+c(OH﹣)
c c(HClO)<c(Cl﹣)
d c(Cl﹣)<c(OH﹣)
(5)ClO2是一种更高效、安全的消毒剂,工业上可用ClO2与水中的MnCl2在常温下反应,生成MnO2和盐酸,以除去水中Mn2+,写出该反应的化学方程式(需配平)__.有人认为产物MnO2和盐酸会继续反应生成氯气,这种认识对吗?__(填“对”或“错”),说明理由__.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关认识正确的是
A.各能级按![]() 、
、![]() 、
、![]() 、
、![]() 的顺序所容纳的最多电子数依次为1、3、5、7的2倍
的顺序所容纳的最多电子数依次为1、3、5、7的2倍
B.各能层的能级都是从![]() 能级开始至
能级开始至![]() 能级结束
能级结束
C.各能层含有的能级数为![]()
D.各能层含有的电子数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.同一原子中,![]() 、
、![]() 、
、![]() 电子的能量逐渐减小
电子的能量逐渐减小
B.同一原子中,![]() 上的电子较
上的电子较![]() 上的电子离核远
上的电子离核远
C.能量高的电子在离核近的区域运动,能量低的电子在离线远的区域运动
D.各能层含有的能级数为![]() (
(![]() 为能层序数)
为能层序数)
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图1所示.
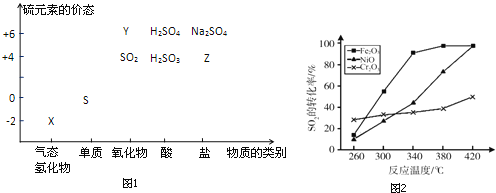
完成下列填空:
(1)图中X的电子式为__;其水溶液在空气中放置易变浑浊,写出反应的化学方程式__;该变化说明S的非金属性比O__(填“强”或“弱”),从原子结构的角度解释原因:__.通过__(举两例),也可以判断氧、硫两种元素的非金属性强弱.
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度,理论上有可能的是__(选填编号).
a Na2S+S b Z+S c Na2SO3+Y d NaHS+NaHSO3
(3)已知反应:Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O,研究其反应速率时,下列方案合理的是__(选填编号).
a 测定一段时间内生成SO2的体积,得出该反应的速率
b 研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c 用Na2S2O3固体分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(4)治理含CO、SO2的烟道气,以Fe2O3做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体.已知:①硫的熔点:112.8℃、沸点:444.6℃;②反应每得到1mol硫,放出270kJ的热量.写出该治理烟道气反应的热化学方程式__.
(5)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图2.不考虑催化剂价格因素,生产中选Fe2O3做催化剂的主要原因是__.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关常温下0.1 mol/L氨水(pH=11)的说法正确的是
A.该氨水显弱碱性
B.加水稀释过程中,![]() 的值减小
的值减小
C.与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+)
D.加入少量NH4Cl 固体,溶液中水的电离平衡:H2O![]() H+ + OH―向右移动
H+ + OH―向右移动
查看答案和解析>>
科目: 来源: 题型:
【题目】与下列事实对应的化学用语错误是( )
A.纯碱溶液能清洗油污:CO32﹣+H2OHCO3﹣+OH﹣
B.配制FeSO4溶液时加入适量的铁粉:Fe3++Fe→2Fe2+
C.含1molNaOH和1molNa2CO3的混合溶液中滴入含1.5molHCl的稀盐酸:2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O
D.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42﹣恰好沉淀完全:2Ba2++4OH﹣+Al3++2SO42﹣→2BaSO4↓+AlO2﹣+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常情况下,五种元素的单质中有三种气体,两种固体。
(1)A为______(填元素符号,下同),B为______,C为______;D的原子结构示意图为______。
(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱:______![]() ______(填化学式)。
______(填化学式)。
(3)A和B可形成原子个数比为![]() 的化合物,其化学式为______。
的化合物,其化学式为______。
(4)将E的单质通入A、B、C三种元素组成的化合物的水溶液中,试写出该反应的化学方程式:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四组物质,用横线上所给的试剂常温下就能鉴别出来的是( )
A.FeO、FeS、CuO、CuS、稀硫酸
B.苯、四氯化碳、无水乙醇、己烯 溴水
C.甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液
D.苯酚钠溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表中的部分元素,请回答下列有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素的符号:①______,⑥______,⑦______。
(2)上述表中的元素中,最活泼的金属元素是______(填元素符号,下同),非金属性最强的元素是______,最不活泼的元素是______。
(3)上述表中元素的最高价氧化物对应的水化物中,酸性最强的是______(填化学式,下同),碱性最强的是______,属于两性氢氧化物的是______,写出这三种物质之间相互反应的化学方程式:______,______,______。
(4)上述表中的元素(不考虑0族元素)中,原子半径最小的是______(填元素符号,下同),原子半径最大的是______。
(5)在③与④中,化学性质较活的是______(填元素符号);在⑧与中,其单质的氧化性较强的是______(填元素符号),请设计实验加以证明:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于元素金属性、非金属性的说法正确的是( )
A.![]() 的酸性强于
的酸性强于![]() ,故非金属性:
,故非金属性:![]()
B.第ⅠA族金属元素是同周期中金属性最强的元素
C.仅用![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,无法验证
溶液,无法验证![]() 、
、![]() 的金属性强弱
的金属性强弱
D.第ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com