
科目: 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )

A.d为石墨,电流从d流入导线进入铁片
B.d为铜片,铜片上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀
D.d为镁片,铁片上电极反应为:2H+ + 2e → H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述正确的是( )
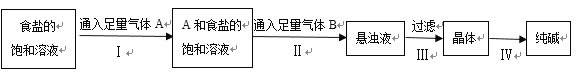
A.第Ⅱ步的离子方程式为Na++NH3+H2O+CO2→NaHCO3↓+NH4+
B.第Ⅲ步得到的晶体是Na2CO310H2O
C.A气体是CO2,B气体是NH3
D.第Ⅳ步操作的过程主要有溶解、蒸发、结晶
查看答案和解析>>
科目: 来源: 题型:
【题目】金、银、铜、铁、铝和钛均是人类生产和生活中大量使用的金属。试回答与上述金属原子结构有关的问题:
(1)上述金属元素中属于主族元素的有______。
(2)钛被称为继铁、铝之后的“第三金属”。基态钛原子外围电子排布图为______。
(3)基态金原子的外围电子排布式为![]() ,试判断金在元素周期表中位于第______周期第______族。
,试判断金在元素周期表中位于第______周期第______族。
(4)已知![]() 与
与![]() 位于同一族,则
位于同一族,则![]() 在元素周期表中位于______区。
在元素周期表中位于______区。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )

A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)气态烃D是石油裂解产品之一,标准状况下D的密度为1.25 g·L-1,根据下列转化关系推断:
A![]() B
B![]() C、A
C、A![]() D
D![]() E
E
请写出A、C、E的结构简式:A________、C________、E________。
(2)写出下列反应的化学方程式:A―→B:_________________________________________;
D―→E:_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,如图所示是有关合成路线图.
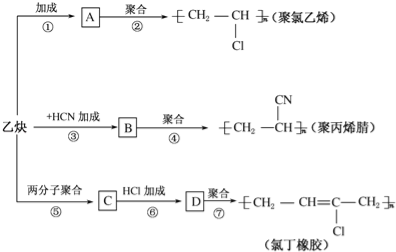
已知反应:nCH2═CH﹣CH═CH2![]()
![]()
请完成下列各题:
(1)写出物质的结构简式:A ,C .
(2)写出反应的化学方程式
反应②: ;
反应③: ;
反应⑥: .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于炔烃的叙述正确的是
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.乙烯比乙炔的含碳量高
C.相同质量的乙炔和甲烷完全燃烧后生成水的质量相同
D.炔烃和烯烃都属于不饱和烃,其性质具有一定的相似性,如都不能使溴水褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol冰醋酸和1mol乙醇经催化加热反应可生成H2O分子数为NA
B.常温常压下,将15g NO和8g O2混合,所得混合气体分子总数小于0.5NA
C.标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4NA
D.6.8g熔融态KHSO4中含有0.1NA个阳离子
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________________,K值大小与温度的关系是:温度升高,K值__________(填一定增大、一定减小、或可能增大也可能减小)。
(2)已知反应Cl2+H2O![]() HCl+HClO,写出该反应化学平衡常数的表达式_____________
HCl+HClO,写出该反应化学平衡常数的表达式_____________
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-QkJ/mol (Q>0)
CO2(g)+H2(g) ΔH=-QkJ/mol (Q>0)
CO和H2O浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)
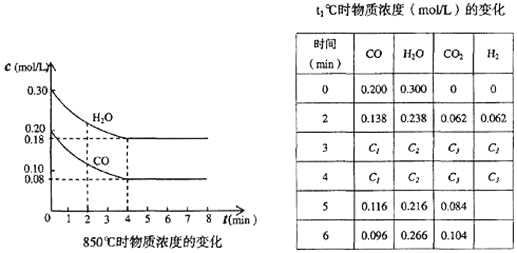
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min问,平衡向逆方向移动,可能的原因是_______,表中5 min~6 min之间数值发生变化,可能的原因是_______。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合硫酸铁是一种新型高效的无机高分子絮凝剂。用硫酸亚铁晶体及硫酸为原料催化氧化法生成硫酸铁,再水解、聚合成产品。实验室模拟生产过程如下:
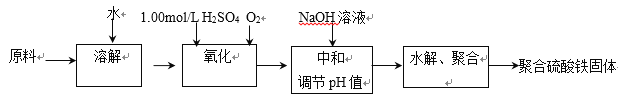
(1)①用原料配制2.50 mol/L的FeSO4溶液时用到的定量仪器有:____________________
②写出氧化过程中的离子方程式:_________________________________________
(2)综合考虑实际投料硫酸亚铁与硫酸的物质的量之比为![]() 左右最佳。 加入的硫酸比理论值稍多,但不能过多的原因是____________________________________________________________________。
左右最佳。 加入的硫酸比理论值稍多,但不能过多的原因是____________________________________________________________________。
(3)硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(x Fe2O3·y SO3·z H2O),现采用重量法测定x、y、z的值。
①测定时所需的试剂____________。
(a) NaOH (b) Ba(OH)2 (c) BaCl2 (d) FeSO4
②需要测定____________和____________的质量(填写化合物的化学式)。
(4)选出测定过程中所需的基本操作____________(按操作先后顺序列出)。
a.过滤、洗涤
b.蒸发、结晶
c.萃取、分液
d.冷却、称量
e.烘干或灼烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com