
科目: 来源: 题型:
【题目】(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4![]() N2↑+6 NH3↑+3SO2↑+SO3↑+7H2O 将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是
N2↑+6 NH3↑+3SO2↑+SO3↑+7H2O 将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是
A.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:1
B.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:2
C.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:3
D.从溶液中逸出的气体只有N2,最后留下溶液中溶质只有较多的NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】“84”消毒液的成分是NaClO,某化学研究性学习小组在实验室制备NaClO并探究其性质。
(1)该学习小组用如图装置进行实验(部分夹持装置略去),反应一段时间后,取C瓶中的溶液进行实验,测得溶液的pH=12。
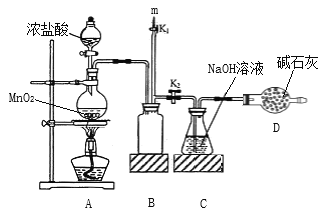
(查阅资料:饱和NaClO溶液pH为11)。
回答下列问题:
①装置A中发生反应的离子方程式为_______________________________。
②B装置的作用是__________________。
③C瓶溶液中的溶质是NaCl、______________(填化学式)。
(2)实验结束后,在m处最好连接盛________(填“NaOH 溶液”或“水”) 的注射器,然后打开K1关闭K2,最后再拆除装置。
(3)测定C瓶溶液中NaClO含量的实验步骤如下:
步骤1:将C瓶溶液加入硫酸酸化,加入过量KI溶液,塞紧瓶塞并在暗处充分反应后滴入5~6滴淀粉溶液。
步骤2:分两次各取步骤1的溶液20mL于锥形瓶中,用0.1000mol·L-1 Na2S2O3 标准溶液滴定,滴定终点时两次耗Na2S2O3 溶液体积的平均值为16.00mL。(已知:I2+2S2O32- =2I-+S4O62-)
①步骤1的C瓶中发生反应的离子方程式为:___________________________________。
②滴定终点的现象为______________________________________________________。
③塞紧瓶塞并在暗处反应的原因是_____________________________________。
④C瓶溶液中NaClO含量为____________g·L-1。
⑤若盛Na2S2O3 标准溶液的滴定管未用Na2S2O3 标准溶液润洗,则测得C瓶溶液中NaClO含量__________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,盐酸和硫酸的混合溶液20 mL,向混合物中逐滴加入0.05mol/LBa(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。
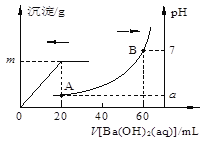
下列说法正确的是
A.图中A点对应溶液的pH:a=1
B.生成沉淀的最大质量m=2.33g
C.原混合液中盐酸物质的量浓度为0.1mol/L
D.当V[Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++ SO42-=BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
【题目】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题:
(1)FeCl3溶液呈________性(填“酸”、“中”或“碱”),原因是__________________(用离子方程式表示);若把FeCl3溶液蒸干,灼烧,最后得到固体产物是 ____________,原因是________________________________________________。
(2)将1L 0.2 mol·L-1HA溶液与1L 0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则混合溶液中c(HA)+c(A-)_____0.1 mol·L-1(填“>”、“<”或“=”)。
(3)浓度均为0.1 mol/L的四种溶液①氯化铵溶液、②碳酸氢铵溶液、③氨水、④硫酸氢铵中,NH4+浓度由大到小的顺序为_______________________________。
(4)铅蓄电池是典型的可充电型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。放电时,负极的电极反应式是__________________________;充电时,当外电路通过1 mol电子时,理论上正极板的质量减少________________g。
2PbSO4+2H2O。放电时,负极的电极反应式是__________________________;充电时,当外电路通过1 mol电子时,理论上正极板的质量减少________________g。
(5)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3 ,为了得到纯净的MgCl2·2H2O晶体,应加入________(填化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________mol·L-1。
②常温下,若将0.01 mol·L-1 MgCl2溶液与________ mol·L-1 NaOH溶液等体积混合时有沉淀生成。
查看答案和解析>>
科目: 来源: 题型:
【题目】通过下列实验现象的分析,对实验事实的解释正确的是( )
A.向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,说明BaCl2有酸性
B.H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强
C.用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色,说明浓氨水呈碱性
D.常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸发应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
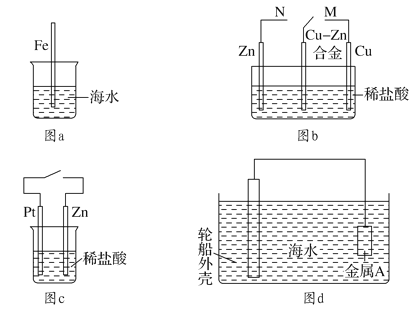
A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度
查看答案和解析>>
科目: 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A.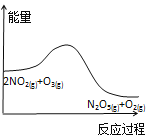 降低温度,平衡向正反应方向移动
降低温度,平衡向正反应方向移动
B. 0-3s内,反应速率v(NO2)=0.2mol·L-1
0-3s内,反应速率v(NO2)=0.2mol·L-1
C.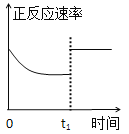 t1时仅加入催化剂,平衡正向移动
t1时仅加入催化剂,平衡正向移动
D.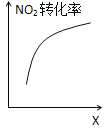 达到平衡时,仅改变X,则X为c(O2)
达到平衡时,仅改变X,则X为c(O2)
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物是药物生产的中间体,其结构简式如图。下列有关叙述正确的是
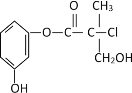
A.该有机物与溴水可发加成反应
B.该有机物与浓硫酸混合共热可发生消去反应
C.1 mol该有机物与足量NaOH溶液反应最多消耗3molNaOH
D.该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2H2(g)+O2(g)→2H2O(g)+483.6kJ。下列说法或表达正确的是( )
A.在相同的条件下,2mol氢气与1mol氧气的总能量小于2mol水蒸气的总能量
B.H2(g)+![]() O2(g)→H2O(1)+Q1;Q1>241.8kJ
O2(g)→H2O(1)+Q1;Q1>241.8kJ
C.氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生
D.任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量
查看答案和解析>>
科目: 来源: 题型:
【题目】“垃圾是放错了位置的资源”,应该分类回收。某化学兴趣小组拟采用如下处理方法回收废电池中的资源。
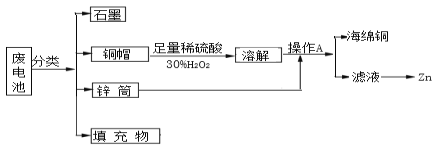
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2 , 其正极的电极反应式为_____________________________________________。
(2)操作A的名称为____________________ 。
(3)铜帽溶解时加入H2O2的目的是___________________ (用化学方程式表示)。铜帽溶解完全后,可采用________ 方法除去溶液中过量的H2O2 。
(4)填充物中可以回收得到氯化铵,写出氯化铵溶液中各离子浓度的大小顺序_________________________________。
(5)铜器在潮湿环境中发生的电化学腐蚀如图所示:
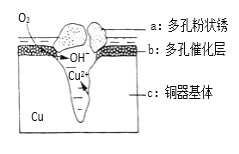
①负极反应的电极反应式 ________________________。
②环境中的Cl﹣扩散到孔口,并与正极反应产物和负极产物作用生成多孔粉状锈Cu2(OH)3Cl,其若生成4.29g Cu2(OH)3Cl,则理论上耗氧气体积为________L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com