
科目: 来源: 题型:
【题目】一定条件下,a L密闭容器中放入1molN2和3molH2发生N2+3H2![]() 2NH3的反应,下列选项中能说明反应已达到平衡状态的是
2NH3的反应,下列选项中能说明反应已达到平衡状态的是
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.2v(H2)=3v(NH3)
C.单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
D.单位时间消耗0.1molN2的同时,生成0.2molNH3
查看答案和解析>>
科目: 来源: 题型:
【题目】三氧化钼(MoO3)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分
为MoS2)通过一定条件来制备。回答下列相关问题:
(1)已知:①MoS2(s)Mo(s)+S2(g) △H1;
②S2(g)+2O2(g)2SO2(g) △H2;
③2Mo(s)+3O2(g)2MoO3(s) △H3
则2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H=______(用含△H1、△H2、△H3的代数式表示)。
(2)若在恒温恒容条件下仅发生反应MoS2(s)Mo(s)+S2(g)
①下列说法正确的是______(填字母)。
a.气体的密度不变,则反应一定达到了 平衡状态
b.气体的相对分子质量不变,反应不定处于 平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时S2(g)的浓度为1.4 molL-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度______(填“>“<“或“=“)1.4 molL-1。
(3)在2L恒容密闭容器中充入1.0 molS2(g)和1.5 mol O2(g),若仅发生反应:S2(g)+2O2(g)2SO2(g),5 min后反应达到平衡,此时容器压强为起始时的80%,则0~5 min内,S2(g)的反应速率为______molL-1min-1。
(4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H.测得氧气的平衡转化率与起始压强、温度的关系如图所示:
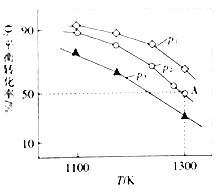
①△H______(填“>“*<“或“=“)0;比较p1、p2、p3的大小:______
②若初始时通入7.0molO2,p2为7.0 kPa,则A点平衡常数Kp=______(用气体平衡分压代替气体平衡浓度计算。分压=总压×气体的物质的量分数,写出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1反应Ⅱ:N2H4(g)+H2(g)2NH3(g)ΔH2=-41.8 kJ·mol-1
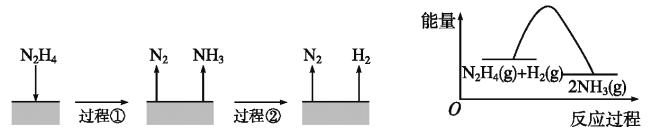
下列说法不正确的是()
A. 图所示过程①是放热反应
B. 反应Ⅱ的能量过程示意图如图所示
C. 断开3 mol N2H4(g)的化学键吸收的能量大于形成1 molN2(g)和4 mol NH3(g)的化学键释放的能量
D. 200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g)ΔH=+50.7 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )

A. 0.5% B. 1.0% C. 0.1% D. 1.5%
查看答案和解析>>
科目: 来源: 题型:
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O | K1=1.75×10-5mol·L-1 |
CH3COO-+H2O | K2=5.71×10-10mol·L-1 |
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大
查看答案和解析>>
科目: 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,其单质及化合物在航天、军事、航海、医疗等领域都有着重要的应用。请回答下列问题:
(1)在元素周期表中,锆元素与钛元素同族,则锆元素位于__区。
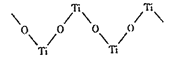
(2)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形成存在的钛酰阳离子,其结构如图所示,若阳离子所带电荷为+n,则该离子中钛原子数为__。
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个Al原子与__个N原子相连,与同一个N原子相连的Al原子构成的立体构型为___,氮化铝晶体属于___晶体。
(4)Ti3+可形成配位数为6的两种配合物晶体(一种是紫色,一种是绿色),组成皆为TiCl36H2O。向含有0.01mol绿色配合物晶体的水溶液中加入过量硝酸银溶液,产生0.02molAgCl沉淀,则绿色配合物晶体的化学式为__。
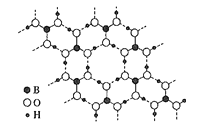
(5)硼与铝同族,硼酸晶体是片层结构,其中一层的结构如图所示,层内的分子以氢键相连。含1mol硼酸的晶体中有__mol氢键。图中所示最外层已达8原子结构的原子是__(填元素符号),H3BO3晶体中B原子个数与极性键个数比为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A.25 ℃时,H2CO3的一级电离Ka1(H2CO3)=1.0×10-6.4
B.M点溶液中:c(H+)+ c(H2CO3)=c(Cl-) +2c(CO32-) +c(OH-)
C.25 ℃时,HC![]() +H2O
+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.图中a=2.6
查看答案和解析>>
科目: 来源: 题型:
【题目】用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是
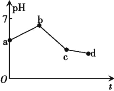
A.ab段H+被还原,溶液的pH增大
B.原溶液中KCl和CuSO4的物质的量浓度之比为2∶1
C.c点时加入适量CuCl2固体,电解液可恢复原来浓度
D.cd段相当于电解水
查看答案和解析>>
科目: 来源: 题型:
【题目】继去年12月西安交大研发了新型石墨烯量子点白光发光材料,并成功应用到白光WLED器件中,2019年8月,中国科学院福建物质结构研究所合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2,并获得了该化合物的LED器件。
(1)石墨烯(图Ⅰ)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图Ⅱ)。
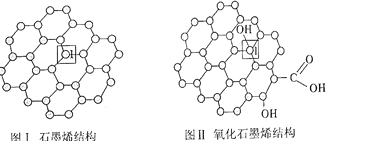
①在石墨烯晶体中,每个C原子连接__个六元环,每个六元环占有___个C原子。
②图Ⅱ中1号C与相邻C形成的键角__(填“>”、“<”或“=”)图Ⅰ中1号C与相邻C形成的键角,理由是__。
(2)已知氮化硼与砷化镓属于同种晶体类型。砷化镓以第三代半导体著称,熔点为1230℃,具有空间网状结构,两种晶体熔点较高的是__(填化学式),其理由是__。
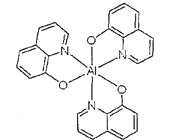
(3)8-羟基喹啉铝是OLED中的重要发光材料及电子传输材料,其微观结构如图所示,8-羟基喹啉铝中存在的化学键为___。
A.离子键 B.极性键 C.非极性键 D.配位键 E.π键 F.金属键
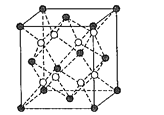
(4)已知BaF2晶体是面心立方结构,晶胞结构如图所示。晶胞中代表F原子的是__(填“黑”或“白”)球。已知BaF2晶胞参数为apm,设阿伏加德罗常数的值为NA,则BaF2的密度是__gcm-3(列出计算表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理;其主反应历程如图所示(H2→![]() H+
H+![]() H)。下列说法错误的是( )
H)。下列说法错误的是( )
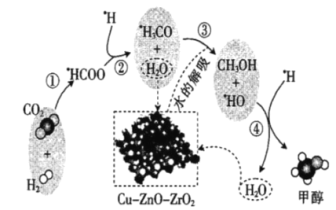
A.二氧化碳加氢制甲醇的过程中原子利用率达100%
B.带标记的物质是该反应历程中的中间产物
C.向该反应体系中加入少量的水能增加甲醇的收率
D.第③步的反应式为![]() H3CO+H2O→CH3OH+
H3CO+H2O→CH3OH+![]() HO
HO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com