
科目: 来源: 题型:
【题目】某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示:

已知:[Cu(NH3)4]2+(aq) ![]() Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
A.气体X中含有SO2
B.为实现溶液C到溶液D的转化,加NH3·H2O至红棕色沉淀刚好完全,过滤即可
C.蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4 ]Cl2 + H2O![]() CuO + 2HCl↑+ 4NH3↑
CuO + 2HCl↑+ 4NH3↑
D.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.向CaCl2 溶液中通入少量CO2气体:Ca2+ + CO2 + H2O=CaCO3↓ + 2H+
B.大理石与醋酸反应:CaCO3 + 2CH3COOH= Ca2+ + 2CH3COO-+ H2O + CO2↑
C.制备Fe(OH)3胶体:Fe3+ + 3H2O![]() Fe(OH)3(胶体)+ 3H+
Fe(OH)3(胶体)+ 3H+
D.少量碳酸氢钠溶液与足量石灰水反应:Ca2+ + OH-+ HCO3-=CaCO3↓ + H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4.2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
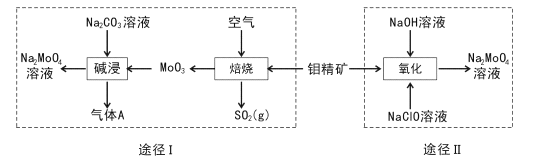
(l) Na2 MoO4![]() 2H2O中钼元素的化合价为____,NaCIO的电子式为 ___。
2H2O中钼元素的化合价为____,NaCIO的电子式为 ___。
(2)途径I为了提高钼精矿焙烧速率,可采取的措施是____(答出两条即可)。
(3)途径I焙烧过程中化学方程式为____,碱浸时气体A的化学式为____。
(4)已知途径I的钼酸钠溶液中c(MoO42-)=0. 40mol/L,c(CO32-)=0. 20mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是____(已知Ksp(BaCO3) =1×10-9、Ksp(BaMo04) =4.0×10-8,忽略溶液的体积变化)。
(5)途径II氧化时溶液中还有Na2SO4生成,则还原剂与氧化剂物质的量之比为_____。
(6)途径I或途径II所得的Na2MoO4溶液经结晶可得固体A后再重结晶可得固体B,其重结晶操作的目的为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
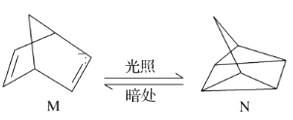
(1)有机物M经过太阳光光照可转化成N,转化过程如下,ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1则a________726.5(填“>”“<”或“=”)
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1则a________726.5(填“>”“<”或“=”)
(3)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:________________________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_______。
(5) 已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的 ΔH=__________________。
(6)已知拆开1 mol H—H键,1 mol N—H键,1mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用KOH为电解质的循环阳极锌空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( )
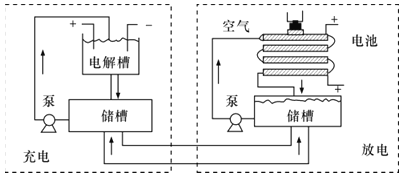
A.放电时,电池正极反应为O2+4e-+2H2O=4OH-
B.放电时,电解质中会生成少量碳酸盐
C.电池停止工作时,锌粉与电解质溶液不反应
D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH-
查看答案和解析>>
科目: 来源: 题型:
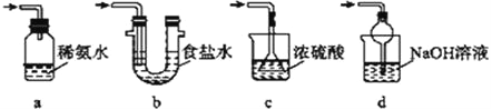
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2![]() Na2S2O5。
Na2S2O5。
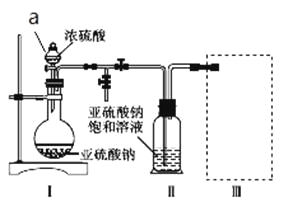
(1)加试剂前要进行的操作是_______________。装置Ⅰ中产生气体的化学方程式为____________。
(2)浓硫酸_______________ (填“能”或“不能”)用稀硫酸代替,原因是_______________。
(3)从装置Ⅱ中分离出产品可采取的分离方法是_______________________。
(4)为了完整实验装置,在下列装置中选择一个最合理的装置放在装置Ⅲ处,可选用的装置(夹持仪器已略去)为___________(填序号)。
实验二:葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O![]() H2SO4+2HI)
H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液30.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果______________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,C、D、E、F、X、Y都是惰性电极,A、B为电源。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.
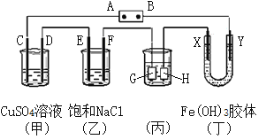
(1)若用CO、氧气燃料电池作电源,电解质为KOH溶液,则A为____极,A电极上的反应为__________________,B电极上的反应式为:__________________________________。
(2)若甲中装有100ml 1 molL-1的硫酸铜溶液,工作一段时间后,停止通电此时C、D两极上产生的气体体积相同.甲中D极产生的气体在标准状况下的体积为_____________L,欲使溶液恢复到起始状态,可向溶液中加入____。
A.CuO B.Cu2(OH)2CO3 C.Cu(OH)2 D.CuCO3
(3)通电后乙中反应的化学方程式:__________________________________。
(4)欲用(丙)装置给铜镀银,反应一段时间后(用CO、氧气燃料电池作电源)铜制品质量增加43.2克,理论上消耗氧气的质量_______克。
(5)工作一段时间后,丁中X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,这说明__________________在电场作用下向Y极移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】配制FeCl3溶液时,将FeCl3固体溶解在较浓的盐酸中,再加水稀释。下列说法正确的是
A.较浓盐酸可有效抑制Fe3+水解
B.稀释过程中FeCl3水解程度增大,c(H+)增大
C.FeCl3溶液中存在Fe3++3H2O=Fe(OH)3↓+3H+
D.FeCl3溶液显黄色,没有Fe(OH)3存在
查看答案和解析>>
科目: 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B<C
查看答案和解析>>
科目: 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。下列说法错误的是
ZnO(s)+2Ni(OH)2(s)。下列说法错误的是
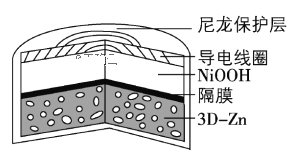
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.放电过程中OH通过隔膜从负极区移向正极区
C.充电时阴极反应为ZnO(s)+H2O(l) +2e= Zn(s)+2OH(aq)
D.放电时正极反应为NiOOH(s)+H2O(l) +e =Ni(OH)2(s)+OH(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com