
科目: 来源: 题型:
【题目】以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(![]() )。下列表述错误的是( )
)。下列表述错误的是( )
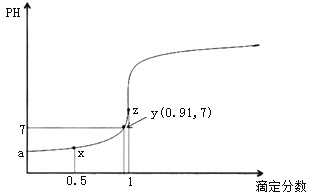
A.z点后存在某点,溶液中的水的电离程度和y点的相同
B.a约为3.5
C.z点处,![]()
D.x点处的溶液中离子满足:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组根据反应:H2O2+2HI=2H2O+I2探究影响化学反应速率的因素。实验数据如下:
实验 编号 | H2O2溶液浓度/(mol·L-1) | HI溶液浓度/(mol·L-1) | 温度/℃ | 反应速率/(mol·L-1·s-1) |
① | 0.1 | 0.1 | 25 | 0.0076 |
② | 0.1 | 0.2 | 25 | 0.0153 |
③ | 0.1 | 0.3 | 25 | 0.0227 |
④ | 0.1 | 0.1 | 35 | 0.0304 |
回答下列问题:
(1)反应:H2O2+2HI=2H2O+I2中,氧化剂是___。
(2)25℃时,表明增大反应物浓度,化学反应速率___(填“增大”或“减小”)。
(3)能表明温度对化学反应速率影响的实验编号是①和___。
(4)H2O2不稳定,写出H2O2发生分解反应的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】电Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(OH)能氧化降解有机污染物。下列说法错误的是
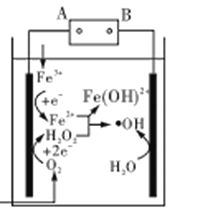
A.电源的A极为负极
B.每消耗2. 24 LO2(标准状况),整个电解池中理论上可产生的OH为0.2 mol
C.与电源B极相连电极的电极反应式为:H2O-e-=H++﹒OH
D.H2O2与Fe2+发生的反应方程式为:H2O2+Fe2+=Fe(OH)2++﹒OH
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,请回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | H | ||||||
2 | C | ||||||
3 | Na | Mg | P | S | Cl |
(1)周期表中第三周期第ⅡA族的元素是_____。
(2)P、S、Cl三种元素中,非金属性最强的是____(填元素符号)。
(3)钠元素最高价氧化物对应水化物的化学式是____,常温下该水化物溶液的pH____(填“>”“<”或“=”)7。
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____(填“放热”或“吸热”)反应。
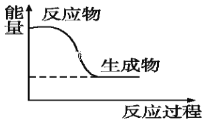
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
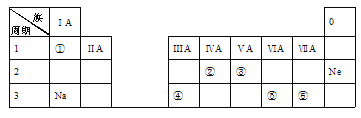
(1)④的原子序数是________;
(2)⑤的原子结构示意图是____________;
(3)②和③两种元素的非金属性强弱关系是:②______③(填“>”、“<”或“=”);
(4)①和⑥两种元素组成的化合物中含有的化学键是_____(填“共价”或“离子”)键。
查看答案和解析>>
科目: 来源: 题型:
【题目】目前,从海水提取的溴占世界溴年产量的三分之一左右,空气吹出法是工业规模海水提溴的常用方法。其中一种工艺流程为:①海水浓缩,酸化;②通入Cl2,使Br— 转化为Br2;③通入空气、水蒸气,将Br2吹入吸收塔,与吸收剂SO2反应转化为HBr;④通入Cl2,再经过一系列处理得到产品Br2。请回答下列问题:
(1)步骤②、③操作的目的是_____(填“富集溴”或“萃取溴”);
(2)在步骤③中,生成HBr的化学方程式是___________;
(3)在步骤②中,若通入22.4LCl2(标准状况),理论上可得Br2__________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置或操作能达到实验目的的是
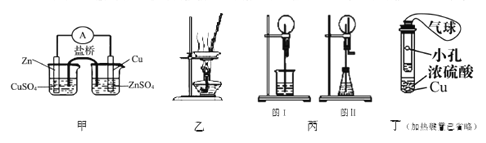
A. 甲装置构成铜锌原电池
B. 用图乙所示装量加热AlCl3饱和溶液然后利用余热蒸干制备AlCl3固体
C. 丙装置里图I烧瓶中充满氨气,烧杯中盛装水,在图II的锥形瓶中,加入足量的Cu与稀硝酸,图I和图II都产生喷泉现象且原理相同
D. 利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)水溶液中的离子平衡是中学化学中重要知识。
①常温下,0.001mol/LNaOH溶液的pH=____;
②(NH4)2SO4是一种重要的氮肥,长期施用会使土壤酸化,其原因是_______(用离子方程式表示);
③已知在25℃:AgCl(s) ![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
(2)甲醇是可再生能源,其燃烧热为726.5kJ·mol-1。下列能正确表示甲醇燃烧的热化学方程式的是____(填字母代号)。
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
B.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
C.CH3OH+![]() O2=CO2+2H2O △H=726.5kJ·mol-1
O2=CO2+2H2O △H=726.5kJ·mol-1
(3)800℃,向某恒容密闭容器中充入反应物A,发生反应2A(g) ![]() 2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
反应时间((min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
c(A)(mol/L) | 1.0 | 0.80 | 0.67 | 0.58 | 0.43 | 0.50 | 0.50 |
请回答下列问题:
①在10-20min内,A的平均反应速率为________mol/(L.min);
②不能说明该反应达到化学平衡状态的是__________(填字母代号);
A.容器内气体密度不再变化 B.容器内气体平均摩尔质量不再变化 C.容器内气体的压强不再变化
③800℃时,平衡常数K=_________;
④若温度将为600℃,其平衡常数K将________(填“增大”、“减小”、或“不变”)。
(4)如图所示,闭合S后不久,可观察到滤纸a端附近呈蓝色,则:
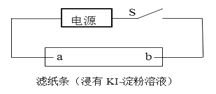
①滤纸b端与电源__________(填“正极”或“负 极”)相连;
②滤纸a端发生的电极反应式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是一种具有多种药理学活性的黄烷酮类药物。实验室由芳香化合物A制备G的合成路线如下:
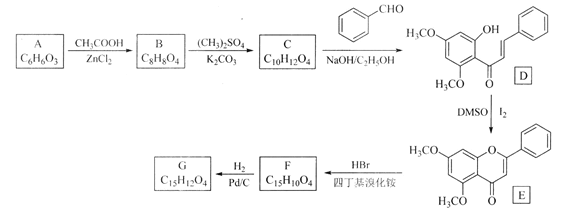
回答以下问题:
(1)A中的官能团名称为________________。E的分子式为________________。
(2)由A生成B和由F生成G的反应类型分别是________________、____________。
(3)由C生成D的化学方程式为____________________。
(4)G的结构简式为____________________。
(5)芳香化合物X是B的同分异构体,可与FeCl3溶液发生显色反应,1molX可与4 mol NaOH反应,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为3:2:2:1。写出一种符合要求的X的结构简式____________。
(6)写出用环戊烯和正丁醛为原料制备化合物![]() 的合成路线(其他试剂任选):__
的合成路线(其他试剂任选):__
查看答案和解析>>
科目: 来源: 题型:
【题目】图为氢氧燃料电池的装置示意图,下列说法正确的是

A. 该装置能将化学能转化为电能
B. 通入氧气的电极为负极
C. 电子由电极B经导线流向电极A
D. 正极反应式为:H2 – 2e- = 2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com