
科目: 来源: 题型:
【题目】已知实验室制取Cl2的化学方程式为:4HCl(浓) + MnO2 ![]() MnCl2 + Cl2↑ + 2H2O。试回答下列问题:
MnCl2 + Cl2↑ + 2H2O。试回答下列问题:
(1)如图为制取Cl2的发生装置。
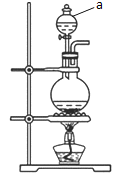
①仪器a的名称是____;
②仪器a中盛放的试剂为____;
(2)如图为Cl2的收集及尾气处理装置。
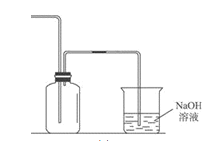
①该气体收集方法为_____;
A 上排空气法 B 下排空气法
②烧杯中发生反应的化学方程式为_________。
(3)欲制得标准状况下2.24L Cl2,至少需要MnO2的质量为___g。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于_________区。
(2)Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ ,请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别:_________。Mn2+的半径_________ Fe3+的半径(填“>”、“<”或“=”)。
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为_________(用含π的式子表示)。
(4)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为_________;[Fe(SCN)(H2O)5]2+中Fe3+的配位数为_________,H2O中氧原子的杂化方式为_________。
(5)二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H![]() )配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π
)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H![]() 的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
A 离子键 B 配位键 C σ 键 D 范德华力
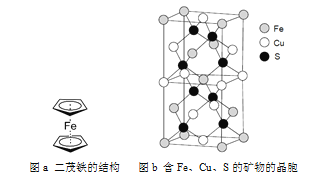
(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如上图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为A pm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________ g/cm3(写出表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜别名一氯化铜为白色立方结晶或白色粉末,难溶于水,不溶于乙醇,在潮湿空气中易被迅速氧化。
Ⅰ.实验室用CuSO4-NaCl混合液与Na2SO3溶液反应制取CuCl。相关装置及数据如图。
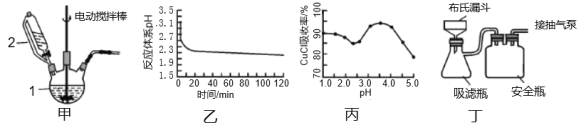
回答以下问题:
(1)甲图中仪器1的名称是___;制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,仪器2中所加试剂为___(填“A”或“B”)
A.CuSO4-NaCl混合液 B.Na2SO3溶液
(2)乙图是体系pH随时间变化关系图,写出制备CuCl的离子方程式___;丙图是产率随pH变化关系图,实验过程中往往用Na2SO3—Na2CO3混合溶液代替Na2SO3溶液,其中Na2CO3的作用是___,并维持pH在___左右以保证较高产率。
(3)反应完成后经抽滤、洗涤、干燥获得产品。抽滤所用装置如丁图所示,其中抽气泵的作用是使吸滤瓶与安全瓶中的压强减小,跟常规过滤相比,采用抽滤的优点是___(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是___。
Ⅱ.工业上常用CuCl作O2、CO的吸收剂,某同学利用如图所示装置模拟工业上测定高炉煤气中CO、CO2、N2、和O2的含量。
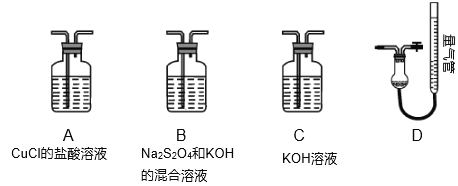
已知:Na2S2O4和KOH的混合液也能吸收氧气。
(4)装置的连接顺序应为___→D。
(5)用D装置测N2含量,读数时应注意___。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼(B)及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B元素的化合价为___。
![]() 工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为___。NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为___。
工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为___。NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为___。
(2)工业上以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:
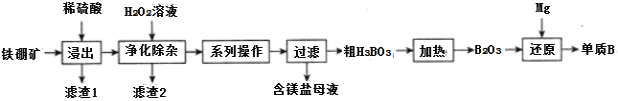
已知:
金属离子 | Fe3+ | Al3+ |
开始沉淀的PH | 2.7 | 3.1 |
沉淀完全的PH | 3.7 | 4.9 |
![]() “浸出”时,将铁硼矿石粉碎的目的为___。
“浸出”时,将铁硼矿石粉碎的目的为___。
![]() 滤渣1的主要成分为___。
滤渣1的主要成分为___。
![]() “净化除杂”时需先加H2O2溶液,其目的为___,然后再调节溶液的pH≈5.0的目的是___。
“净化除杂”时需先加H2O2溶液,其目的为___,然后再调节溶液的pH≈5.0的目的是___。
![]() 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用___(填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为___。
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用___(填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18O49纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
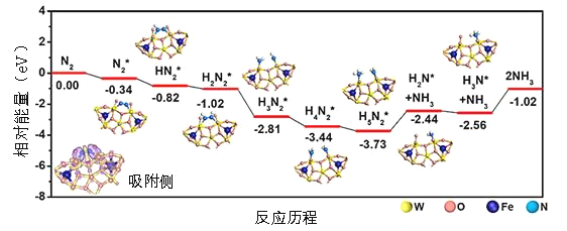
(1)需要吸收能量最大的能垒(活化能)E=__ev,该步骤的化学方程式为___;
(2)对于合成氨反应N2+3H2![]() 2NH3,在标况下,平衡常数Kθ=
2NH3,在标况下,平衡常数Kθ=![]() ,其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压[已知p(NH3)=x(NH3)p,其中p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数]。
,其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压[已知p(NH3)=x(NH3)p,其中p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数]。
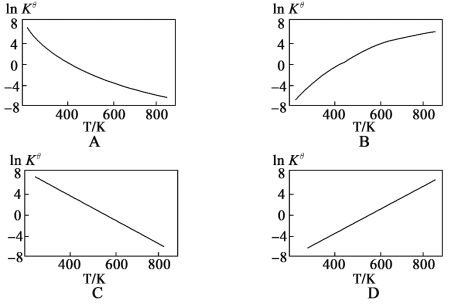
①若起始N2和H2物质的量之比为1:3,反应在恒定温度和标准压强下进行,达到平衡时H2的转化率为ɑ,则Kθ=___(用含ɑ的最简式表示)。
②图中可以示意标准平衡常数Kθ随温度T变化趋势的是___(填序号).
(3)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。
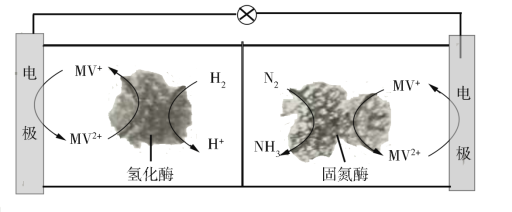
该电池工作时,正极的电极反应为___。中间所用的交换膜应该为___(填“阳离子交换膜”或“阴离子交换膜”或“质子交换膜”)。相比现有工业合成氨,该方法的优点是:___。(任写一条)
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液中除铁时还常用NaClO3作氧化剂,在较小的pH条件下最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。如图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域。下列说法不正确的是( ){已知25℃,Ksp[Fe(OH)3]=2.64×10-39}
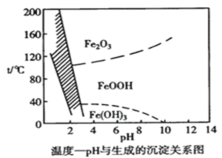
A.在25℃时溶液经氧化,调节溶液pH=4,此时溶液中c(Fe3+)=2.64×10-9mol·L-1
B.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
C.pH=6,温度从80℃升高至150℃体系得到的沉淀被氧化
D.工业生产黄铁矾钠,温度控制在85~95℃pH=1.5左右
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是
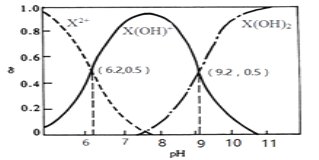
A.Kb2的数量级为10-8
B.X(OH)NO3水溶液显酸性
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中 c(X2+)>c[X(OH)+]
D.在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
| IA | 0 | |||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | Ar | ||||
(1)②的元素符号是_______
(2)①、⑤两种元素的原子半径大小关系:①__⑤(填“>”或“<”);
(3)③、④和⑤中,金属性最强的元素是____(填元素符号);
(4)⑤、⑥的最高价氧化物对应的水化物相互反应的离子方程式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
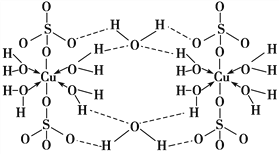
下列有关胆矾的说法正确的是( )
A. 所有氧原子都采取sp3杂化 B. 氧原子参与形成配位键和氢键两种化学键
C. Cu2+的价电子排布式为3d84s1 D. 胆矾中的水在不同温度下会分步失去
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为2K2S2+KI3![]() K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是
K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是![]() ( )
( )
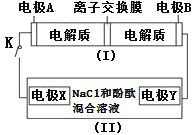
A.闭合K时,K+从左到右通过离子交换膜
B.闭合K时,电极X是阳极
C.闭合K时,电极A的反应式为3I--2e-=I3-
D.闭合K时,当有0.1molK+通过离子交换膜,X电极上产生气体2.24L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com