
科目: 来源: 题型:
【题目】下列有机反应的化学方程式正确的是 ( )
A.CH3CH2Br+NaOH![]() CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
B.2 ![]() + 3Br2 → 2
+ 3Br2 → 2 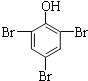 ↓
↓
C.nCH2=CH-CH3![]()
![]()
D.CH3CHO+2Ag(NH3)2OH![]() 2Ag↓+CH3COONH4+3NH3+H2O
2Ag↓+CH3COONH4+3NH3+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H为抗肿瘤药物吡柔比星的活性物质,其一种合成路线如下:
回答下列问题:
(1)A的化学名称是______________。
(2)反应①所需的试剂和条件是__________________。
(3)C的结构简式为_________________。
(4)写出E到F的反应方程式:___________________。
(5)⑦的反应类型是___________________________。
(6)芳香化合物X是H的一-种同分异构体,X中除苯环外不含其他环状结构,X能发生银镜反应、水解反应,写出X的结构简式:____________________________(只需写出3种)。
(7)设计以环已醇(![]() )为原料制备
)为原料制备![]() 的合成路线[无机试剂、P(C6H5)3及N(C2H5)3任用]。________________
的合成路线[无机试剂、P(C6H5)3及N(C2H5)3任用]。________________
查看答案和解析>>
科目: 来源: 题型:
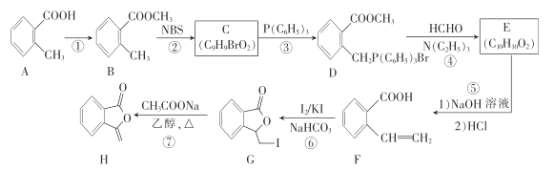
【题目】氯化亚硝酰(NOC1,沸点为-5.5 °C )是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2 + HNO3 =AgNO3+ HNO2。
(1)将5g在300°C下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002 mol NO2。反应12~36 min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为____________, 氯化钾需要“干燥”的原因是_____________。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。
①仪器a的名称为__________。
②干燥管中盛放的试剂为____________。
③生成NOCl的化学方程式为________________。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
步骤 | 实验现象或反应的化学方程式 |
①取5ml三颈烧瓶中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O发应的化学方程式_______ |
②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为___________ |
③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为___________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为铜锌原电池示意图,下列说法正确的是

A. 锌片逐渐溶解 B. 烧杯中溶液逐渐呈蓝色
C. 电子由铜片通过导线流向锌片 D. 该装置能将电能转变为化学能
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe、N及S的化合物用途非常广泛。回答下列问题;
(1)基态Fe原子价电子排布图为____;基态S原子的核外电子占据最高能级的电子云轮廓图为__________形。
(2)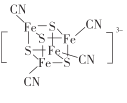 团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
(3)四氟铵可通过下列反应制备:NF3+F2 + BF3 =NF4 BF4
①NF3的空间构型为_____ , 中心原子的杂化方式是______。
②NF4BF4存在的作用力有________(填字母)。
A. σ键 B. π键 C.离子键. D.配位键
(4)Fe与S形成的一种化合物晶体的结构如图所示,六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数的值为NA,该Fe、S化合物晶体的密度为_____(列出计算式)g. cm-3
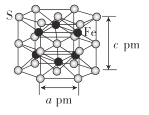
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室里,常用如图所示装置制取并收集氨气。请回答下列问题:
(1)原理与方法
①制取氨气的化学方程式为__________________________________;
②该收集氨气的方法为________。
A.向上排空气法 B.向下排空气法
(2)装置与操作
按下图组装仪器,进行实验。仪器a的名称为____________。

(3)思考与交流
①欲制取标准状况下4.48 L NH3,至少需要NH4Cl________g;
②实验室制取氨气,还可采用下图中的______(填“A”或“B”)。

查看答案和解析>>
科目: 来源: 题型:
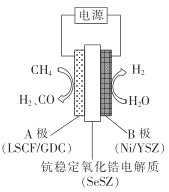
【题目】合成气用途非常广泛,可以煤、天然气等为原料生产。回答下列问题:
(1)用H2O(g)和O2重整CH4制合成气的热化学方程式如下:
(水蒸气重整)CH4(g)+ H2O(g)=CO(g)+3H2(g) H=+ 206 kJ●mol -1
(氧气重整)CH4(g)+0.5O2(g)=CO(g)+2H2(g) H=-36 kJ●mol-1
①2H2(g)+O2(g)=2H2O(g)的 H=_______kJ●mol-1。
②为了保持热平衡,同时用两种方式重整,不考虑热量损失,理论上得到的合成气中n(CO): n(H2)=1 :____(保留两位小数)。
③用水蒸气电催化重整甲烷的装置如图。装置工作时,O2-向_____(填“A"或“B’)极迁移;阳极发生的电极反应为___________。
(2)焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应( I )、(II )的lgKp(Kp为以分压表示的平衡常数)与T的关系如下图所示。
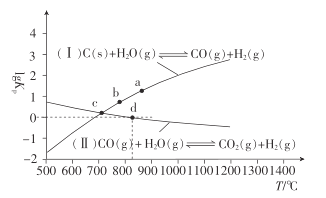
①反应(II)的H_____(填“大于”“等于”或“小于”)0。
②气体的总压强:a点_____ (填“大于”“等 于”或“小于”)b点,理由是_________。
③c点时,反应C(s) +CO2(g)![]() 2CO(g)的Kp=_____ (填数值)。
2CO(g)的Kp=_____ (填数值)。
④在恒容密闭容器中充入0. 5 mol CO、2 mol H2O(g)只发生反应(II),图中d点处达到平衡时,CO的转化率为_______;达到平衡时,向容器中再充入0.5 mol CO、2 mol H2O(g),重新达到平衡时,CO的平衡转化率_______(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,用0.1000 mol· L -1的NaOH溶液滴定0. 1000 mol· L -1的顺丁烯二酸H2A的滴定曲线如下图所示(pKa= lgKa),下列说法错误的是
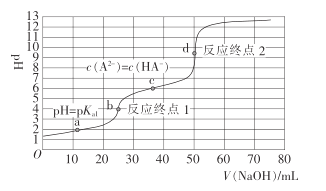
A.用NaOH溶液滴定NaHA溶液可用酚酞作指示剂
B.a点:c(HA-)=c(H2A)
C.H2A的Ka2=10-6
D.d点:c(Na+)<c(HA-)+2c(A2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组为了探究碳与浓H2SO4反应的产物,将浓H2SO4和木炭反应产生的气体进行以下实验:
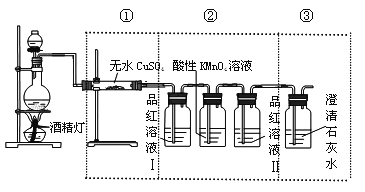
(1)气体通过无水硫酸铜,固体变蓝。说明气体中含有__________;
(2)气体通入品红溶液,溶液褪色;微热,溶液恢复红色。说明气体中含有__________(填“SO2”或“CO2”);
(3)气体通入足量的澄清石灰水,产生白色沉淀。该小组认为气体中含有CO2,你认为该结论:__________(填“正确”或“不正确)。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生反应生成中间体Fe。下列说法不正确的是
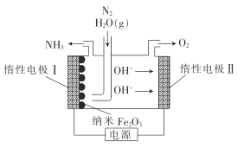
A.惰性电极II是电解池的阳极,发生氧化反应
B.生成氨气的反应:2Fe+N2+3H2O=Fe2O3+2NH3
C.惰性电极I的电极反应:Fe2O3+3H2O+6e -=2Fe+ 6OH-
D.产生2.24LO2时,转移的电子数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com