
科目: 来源: 题型:
【题目】实验室有一瓶淡黄色粉末,标签已脱落。某学习小组为确定其成分,进行实验探究。
(提出猜想)淡黄色粉末成分可能是
猜想一:硫黄
猜想二:过氧化钠
(实验步骤)
①按下图组装仪器;
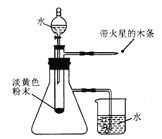
②………
③打开分液漏斗,滴加水;
④用带火星的木条靠近导气管的尖嘴处。
(实验现象)试管中剧烈反应,产生大量气泡;带火星的木条复燃;小烧杯中的导管口有气泡冒出;试管内最终得到无色溶液。
(结论与分析)
(1)实验步骤②迸行的操作是_______;(填字母代号)
A.先加入试剂,后检查装置气密性 B.先检查装置气密性,后加入试剂
(2)根据上述现象分析,猜想________正确;
(3)带火星的木条复燃,说明反应生成的气体是________;
(4)小烧杯中的导管口有气泡冒出,说明淡黄色粉末与水反应是_________(填“放热”或“吸热”)反应;
(5)淡黄色粉末与水反应的化学方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可采用丙烯氨氧化法制丙烯脂,回答下列问题:
I.丙烯的制备反应方程式为C3H8(g)=C3H6(g)+H2(g)。
已知:部分共价键的键能如下:
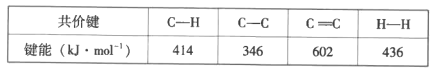
(1)制备丙烯反应的△H=__。该反应在__(“高温”或“低温”)下有利于自发进行。
(2)提高丙烯产率可以选择__(填序号)。
A.升温 B.减小压强 C.充入H2(恒容) D.加入催化剂
(3)已知:CO2(g)+H2(g)=CO(g)+H2O(g) H=-41kJ·mol-1,工业上选择向反应体系中加入CO2,提高丙烷的转化率,从化学平衡原理角度说明原因:__。
II.利用丙烯制备丙烯腈,反应方程式如下:2C3H6(g)+2NH3(g)+3O2(g)![]() 2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
(4)主要的反应机理如下:
CH3-CH=CH2→[CH2![]() CH
CH![]() CH2]+H 慢 H>0
CH2]+H 慢 H>0
[CH2![]() CH
CH![]() CH2]+[NH]→CH2=CH-CN+3H 快
CH2]+[NH]→CH2=CH-CN+3H 快
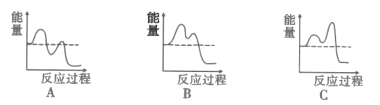
如图能表示反应历程的是__(填序号)。.
(5)一定温度下,IL恒容密闭容器中充人等物质的量的C3H6、NH3、O2制备丙烯腈,c(C3H6)与v正随时间变化的数据如下表:
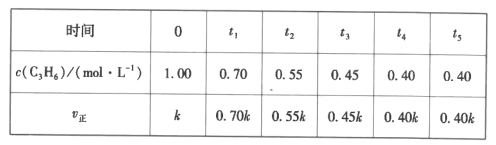
①判断t4时刻反应是否已经达到平衡状态并说明理由:__。
②列式并计算制备丙烯腈反应的平衡常数K=__(mol·L-1)-5。
③已知:正反应速率v正=kca(C3H6),根据表中数据,a=__。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
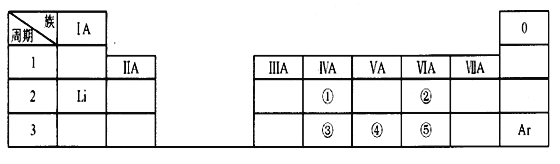
(1)①的元素符号是_________;
(2)②的原子结构示意图是_________;
(3)①和③的原子半径大小关系是:①____③(填“>”、“<”或“=”);
(4)③、④和⑤中,最高价氧化物对应的水化物酸性最强的酸的化学式是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B和C为常见气体,A是所有气体中密度最小的气体;B是黄绿色气体;C能使湿润的红色石蕊试纸变蓝。D是目前用量最大,用途最广的金属。请回答下列问题:
(1)A是________(填化学式)
(2)实验室制取C时,常用________(填“向下”或“向上”)排空气法收集;
(3)B与D的单质在点燃条件下反应的化学方程式为______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇是生活中常见的有机物,可以发生下列转化:
请根据题意填空:
(1)交警查酒驾,通常让司机向盛有酸性重铬酸钾的测试仪吹气,若变色,说明司机饮了酒,该过程中乙醇最终被氧化为___________________(填“CH3CHO”或“CH3COOH”);
(2)CH3CH2OH的官能团是____________(填“羟基”或“羧基”);
(3)CH3COOH + CH3CH2OH ![]() CH3COOCH2CH3 + H2O,在该反应中浓硫酸的作用是吸水剂和_____________(填“催化剂”或“氧化剂”)。
CH3COOCH2CH3 + H2O,在该反应中浓硫酸的作用是吸水剂和_____________(填“催化剂”或“氧化剂”)。
查看答案和解析>>
科目: 来源: 题型:
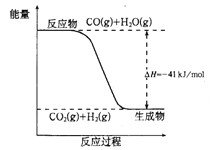
【题目】(1)化学反应过程中,不仅有物质的变化,还伴随有能量的变化。根据下图写出反应的热化学方程式__________。
(2)化学反应速率和化学平衡是化学反应原理的重要组成部分。将4.0 molPCl3和2.0 molCl2充入10L恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g) ![]() PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。
PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。
①在0~2min内,用Cl2表示的反应速率为:![]() (Cl2) =_____mol/(L·min) ;
(Cl2) =_____mol/(L·min) ;
②达到平衡时,PCl3的转化率为________;
③如果再通入1.0 molCl2,相同温度下重新达到平衡时,PCl5的物质的量________。(填字母代号)
A.增大 B.减小 C.不变
(3)水的电离与溶液的酸碱性密切相关。
①常温下,某柠檬水溶液的pH=3,其中的c(OH-)=______mol/L;
②常温下,浓度均为0.1mol/L的CH3COOH溶液和CH3COONa溶液中,水的电离程度大小关系是:前者____后者(填“大于”、“小于”或“等于”);
③常温下,浓度均为0.1mol/L的NaX和NaY两种盐溶液,其pH分别为8和10,则HX和HY的酸性强弱关系是:HX____HY(填“>”或“<”)。
(4)研究化学能与电能相互转化的装置、过程和效率的科学,叫做电化学。
①某原电池装置如图,则该原电池的负极是____(填“Zn”或“Cu”),正极的电极反应式为_______;
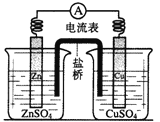
②用铂电极电解某金属氯化物(XCl2)的溶液,当收集到2.24L Cl2(标准状况)时,阴极增重6.4g,则该金属的相对原子质量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,分别向1L0.1mol·L-1MgCl2和MnCl2溶液中加入Na2CO3,固体(忽略体积变化),如图为加入Na2CO3的物质的量与-1gc(Mg2+)或-lgc(Mn2+)之间的关系,已知常温下Ksp(MgCO3)>Ksp(MnCO3),下列说法正确的是( )
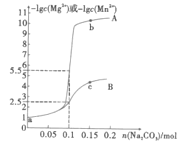
A.曲线A是n(Na2CO3)与-lgc(Mg2+)的关系曲线
B.Ksp(MnCO3)和Ksp(MgCO3)相差3个数量级
C.若将b点和c点溶液混合,存在![]() =1×106
=1×106
D.a点(MgCl2溶液)中存在:c(Mg2+)+c(H+)=c(OH-)+c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,互为同分异构体的是
A. O2和O3
B. CH3CH3和CH2=CH2
C. ![]() 和
和
D. CH3CH2CH2CH2 CH3和(CH3)2CH CH2CH3
查看答案和解析>>
科目: 来源: 题型:
【题目】一种储能较大的新型可充电锌溴液流电池工作原理如图所示。下列说法不正确的是( )
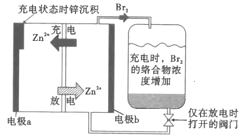
A.电极a在充电时连接电源的负极
B.放电时,电极b发生的反应是Zn2++2e-=Zn
C.放电时,电极b附近的Zn2+和Br-的浓度均增加
D.电池采用澳络合剂将溴单质络合,可以提高系统的安全性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com