
科目: 来源: 题型:
【题目】常温下,分别向NaX溶液和YCl溶液中加入盐酸和氢氧化钠溶液,混合溶液的pH与离子浓度变化关系如图所示,下列说法不正确的是

A.L1表示![]() 与pH的变化关系
与pH的变化关系
B.Kb(YOH)=10-10.5
C.a点时两溶液中水的电离程度不相同
D.0.1mol·L-1的YX溶液中离子浓度关系为:c(Y+)>c(X-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数![]() (X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是
(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是![]()
![]()
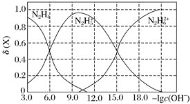
A.Kb1(N2H4)=10-6
B.反应![]() 的pK=9.0(已知:Pk=-lgK)
的pK=9.0(已知:Pk=-lgK)
C.N2H5Cl溶液中c(H+)>c(OH-)
D.N2H5Cl溶液中存在c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】电Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(OH)能氧化降解有机污染物。下列说法错误的是
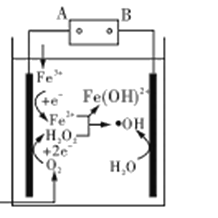
A.电源的A极为负极
B.每消耗2. 24 LO2(标准状况),整个电解池中理论上可产生的OH为0.2 mol
C.与电源B极相连电极的电极反应式为:H2O-e-=H++﹒OH
D.H2O2与Fe2+发生的反应方程式为:H2O2+Fe2+=Fe(OH)2++﹒OH
查看答案和解析>>
科目: 来源: 题型:
【题目】利用碳纳米管能够吸附氢气,设计一种新型二次电池,其装置如图所示。关于该电池的叙述不正确的是( )
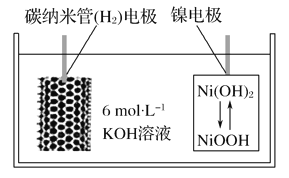
A. 电池放电时K+移向正极
B. 电池放电时负极反应为:H2-2e-+2OH-===2H2O
C. 电池充电时镍电极上NiOOH转化为Ni(OH)2
D. 电池充电时碳纳米管电极与电源的负极相连
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨反应![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g) ![]() NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
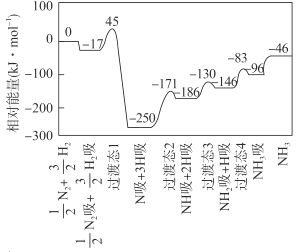
A.该反应的△H = -46 kJ·mol- 1
B.该反应机理中最大活化能为79 kJ·mol- 1
C.升高温度,该反应过渡态的能量会增大
D.该反应达到平衡后增大压强反应正向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
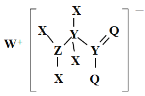
A.Z的最高价氧化物对应的水化物是一元强酸
B.WX的水溶液呈中性
C.元素非金属性的顺序为Y>Z>Q
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+yB(g) ![]() zC(g),图1表示200℃时容器中A、B、C物质的量随时间的变化,图2表示温度与C的体积分数的变化关系,则下列结论正确的是
zC(g),图1表示200℃时容器中A、B、C物质的量随时间的变化,图2表示温度与C的体积分数的变化关系,则下列结论正确的是
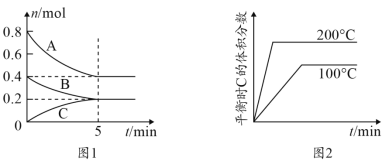
A.由图可知该反应为2A(g)+B(g) ![]() C(g) ΔH<0
C(g) ΔH<0
B.200℃,该反应的平衡常数为25
C.200℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
D.当外界条件由200℃降温到100℃,原平衡被破坏,且正逆反应速率均增大
查看答案和解析>>
科目: 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”![]() 假设盐分以一个NaCl计
假设盐分以一个NaCl计![]() ,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )

A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为![]() 设冰的密度为
设冰的密度为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2 是一种黄绿色易溶于水的气体,具有强氧化性, 回答下列问题:
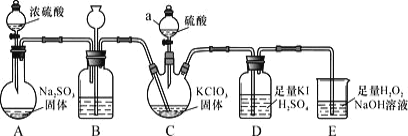
(1)ClO2 的制备及性质探究(如图所示)
①仪器 C 的名称为_________,装置 B 的作用是________。
②装置C 用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为_____,装置 D 中滴有几滴淀粉溶液,其作用是_______。
③装置E 用于吸收尾气,反应生成NaClO2,则该反应中氧化剂与还原剂的物质的量之比为___,氧化产物是___。
(2)粗略测定生成 ClO2 的量实验步骤如下:
a、取下装置 D,将其中的溶液转入 250mL 容量瓶,用蒸馏水洗涤 D 瓶 2~3 次,并将洗涤液一并转移到容量瓶中,再用蒸馏水稀释至刻度。
b、从容量瓶中取出 25.00mL 溶液于锥形瓶中,用 0.1000mol/L 硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去 24.00 mL 硫代硫酸钠溶液。
①滴定至终点的现象是___。
②进入装置 D 中的 ClO2 质量为___,与 C 中 ClO2 的理论产量相比,测定值偏低, 可能的原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】HCl(g)分别在有、无催化剂的条件下分解的能量变化如图所示,下列说法正确的是
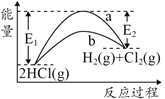
化学键 | H—H | H—Cl | Cl—Cl |
键能kJ·mol-1 | 436 | 431 | 243 |
A.由键能可得1molHCl(g)完全分解需吸收183kJ的能量
B.有催化剂的反应曲线是a曲线
C.a曲线变为b曲线,反应物的活化分子百分数增大
D.b曲线的热化学方程式为:2HCl(g)=H2(g)+Cl2(g) ΔH=-( E1-E2 )kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com