
科目: 来源: 题型:
【题目】可逆反应2A(g)+3B(g)![]() 4C(g)+D(g), 已知起始浓度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D浓度均等于0,反应开始2 秒后达到平衡状态,此时D 的平衡浓度为0.5 mol·L-1,则下列说法不正确的是( )
4C(g)+D(g), 已知起始浓度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D浓度均等于0,反应开始2 秒后达到平衡状态,此时D 的平衡浓度为0.5 mol·L-1,则下列说法不正确的是( )
A. 反应速率v(C)= 1mol/(L·s) B. C的平衡浓度为4mol /L
C. A的转化率为25% D. B的平衡浓度为1.5mol /L
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g) ![]() pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是

A.T1<T2 p1<p2 m+n>p放热反应
B.T1>T2 p1<p2 m+n<p吸热反应
C.T1<T2 p1>p2 m+n>p放热反应
D.T1>T2 p1<p2 m+n>p吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+2B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.C的生成速率与C分解的速率相等
B.单位时间内生成nmol A,同时生成2nmol B
C.单位时间内消耗nmol A,同时生成2nmol C
D.B的生成速率与C分解的速率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,电池反应如下: PbO2 + Pb + 2H2SO4 ![]() 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
A. PbO2放电时是电池的负极,充电时是电池的阳极
B. 负极的电极反应式为:Pb + SO42—– 2e–=PbSO4
C. 放电时,PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
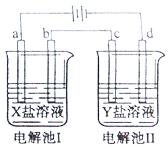
选项 | X | Y |
A. | CuSO4 | AgNO3 |
B. | AgNO3 | NaCl |
C. | FeSO4 | Al2(SO4)3 |
D. | MgSO4 | CuSO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
![]() (g)
(g)![]()
![]() (g)+H2(g) △H
(g)+H2(g) △H
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)500℃时,在恒容密闭容器中,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a_______b(填“>” “<”或“=”),乙苯的转化率将________(填“增大” “减小”或“不变”)。
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
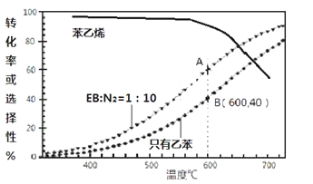
①A,B两点对应的正反应速率较大的是________。
②掺入N2能提高乙苯的平衡转化率,解释说明该事实___________________________。
③用平衡分压代替平衡浓度计算600℃时的平衡常数Kp=________。(保留两位有效数字,分压=总压×物质的量分数)
④控制反应温度为600℃的理由是___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家合成一种新化合物(如图所示)。

其中W、X、Y、Z为同周期元素,W是所在周期中第一电离能最小的元素,Y元素基态原子的未成对电子数等于其电子层数,Z元素的原子核外最外层电子数是X核外电子数的一半。
回答下列问题:
(1)W、X、Y、Z原子半径由大到小的顺序为__(用对应的元素符号表示)。
(2)Z的核外电子排布式为__。
(3)基态X原子价电子轨道表示式为__。
(4)W元素基态原子核外电子有__种运动状态,其中电子占据能量最高的原子轨道符号表示为__。
(5)X的电负性__(填“大于”或“小于”)Y,原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用.某校研究小组尝试回收废旧正极材料中的钴。
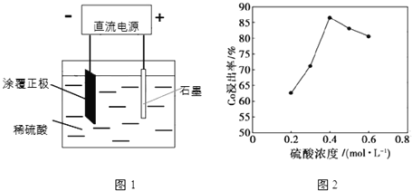
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O,阳极的电极反应式为______。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4molL-1时,钴的浸出率下降,其原因可能为______。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式______。该步骤一般在80℃以下进行,温度不能太高的原因是______。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是______(填字母序号)。
a.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
b.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(HC2O42-)
c.c(NH4+)+c(NH3H2O)=2[c(HC2O42-)+c(HC2O4-)+c(H2C2O4)]
查看答案和解析>>
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在食品加工、印染、印刷、制革以及有机合成等工业中应用广泛。实验室模拟工业湿法制备焦亚硫酸钠装置如图所示。
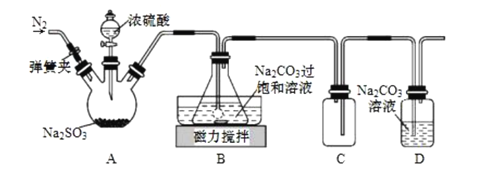
打开弹簧夹,通入一段时间N2后关闭弹簧夹,加入一定量浓硫酸;不断搅拌,控制反应温度在40℃左右,当溶液pH约为4.1时,停止反应,降温至20℃左右静置结晶。
已知:
①温度在40℃左右时,发生反应2NaHSO3=Na2S2O5+H2O。
②温度过高时焦亚硫酸钠分解:Na2S2O5=Na2SO3+SO2↑。
③焦亚硫酸钠与水易发生反应:Na2S2O5+H2O=2NaHSO3。
回答下列问题:
(1)A装置中所加硫酸通常为1:1(体积比)的浓硫酸,一般不采用90%以上的浓硫酸,原因是__。
(2)B装置中控制反应温度40℃在左右的方法是__;锥形瓶中生成NaHSO3的离子方程式为__。
(3)装置C的作用是__。
(4)锥形瓶中析出固体经减压抽滤、洗涤、晾干,可获产品。洗涤操作中依次用饱和SO2水溶液、无水乙醇洗涤,其作用是__。
(5)反应结束后,需要再次打开弹簧夹,通入一段时间N2,目的是__。
(6)某同学认为Na2S2O5属于强碱弱酸盐,在溶液中水解显碱性。实际他测得Na2S2O5溶液显酸性,请用数据帮他分析溶液显酸性的原因__。
(已知:常温下H2SO3电离常数Ka1=1.54×10-2,Ka2=1.02×10-7)
查看答案和解析>>
科目: 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。
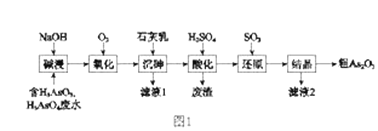
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
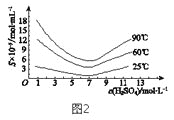
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。
(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com