
科目: 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式 (i)I2(g)+H2(g)![]() 2HI(g) △H=" -" 9.48kJ/mol ,(ii) I2(s)+H2(g)
2HI(g) △H=" -" 9.48kJ/mol ,(ii) I2(s)+H2(g)![]() 2HI(g) △H=" +" 26.48kJ/mol,下列判断正确的是
2HI(g) △H=" +" 26.48kJ/mol,下列判断正确的是
A. 254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1mol气态碘所含的能量相差l7.00 kJ
C. 反应(i)的产物比反应(ii)的产物稳定
D. 反应(i) 拆开1mol I-I键与1mol H-H键需要的总能量小于拆开2mol H-I键需要的总能量
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:![]() △H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
△H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
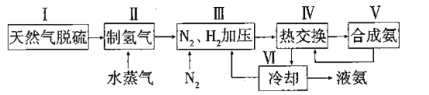
(1)步骤II中制氯气原理如下:
I.![]() △H=+206.4kJ·L-1
△H=+206.4kJ·L-1
II.![]() △H=-41.2kJ·L-1
△H=-41.2kJ·L-1
①对于反应I,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是____________________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应II,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为_______________。
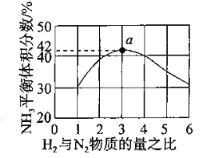
(2)图1表示500℃、60.0Mpa条件下,原料气投料比平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________。
(3)上述流程图中,使合成氨气放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】校化学兴趣小组的同学运用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴酚酞做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着____________________。滴定终点的现象是_________________________。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是___________ (填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为_____mL。
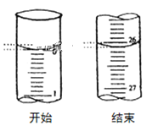
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里,从废旧钴酸锂离子电池的正极材料(在铝箔上涂覆活性物质LiCoO2)中,回收钴、锂的操作流程如下图所示:
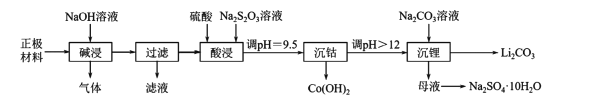
回答下列问题。
(1)拆解废旧电池获取正极材料前,先将其浸入NaCl溶液中,使电池短路而放电,此时溶液温度升高,该过程中能量的主要转化方式为____。
(2)“碱浸”过程中产生的气体是____;“过滤”所得滤液用盐酸处理可得到氢氧化铝,反应的化学方程式为____。
(3)“酸浸”时主要反应的离子方程式为____;若硫酸、Na2S2O3溶液用一定浓度的盐酸替代,也可以达到“酸浸”的目的,但会产生____(填化学式)污染环境。
(4)“沉钴”时,调pH所用的试剂是____;“沉钴”后溶液中c(Co2+)=____。(已知:Ksp[Co(OH)2]=1.09×l0-15)
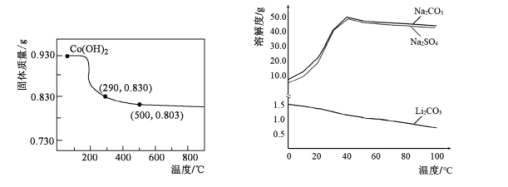
(5)在空气中加热Co(OH)2,使其转化为钴的氧化物。加热过程中,固体质量与温度的关系如左下图所示。290~500℃,发生反应的化学方程式为____。
(6)根据右下图判断,“沉锂”中获得Li2CO3固体的操作主要包括____、____、洗涤、干燥等步骤。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,向某Na2CO3和NaHCO3的混合溶液中逐滴加入BaCl2溶液,溶液中lgc(Ba2+)与![]() 的变化关系如图所示。下列说法正确的是( )
的变化关系如图所示。下列说法正确的是( )
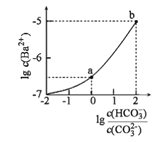
(已知:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11)
A.a对应溶液的pH小于b
B.b对应溶液的c(H+)=4.2×10-7mol·L-1
C.a→b对应的溶液中![]() 减小
减小
D.a对应的溶液中一定存在:2c(Ba2+)+c(Na+)+c(H+)=3c(HCO3-)+c(Cl-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是__________(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②加压___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学按下图所示实验装置探究铜与浓硫酸的反应,记录实验现象见下表。
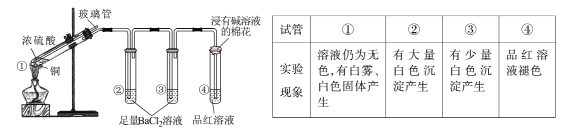
下列说法正确的是
A.②中白色沉淀是BaSO3
B.①中可能有部分硫酸挥发了
C.为确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变
查看答案和解析>>
科目: 来源: 题型:
【题目】在室温下,下列五种溶液:
①0.1 mol·L-1 NH4Cl ②0.1 mol·L-1 CH3COONH4 ③0.1 mol·L-1 NH4HSO4 ④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液 ⑤0.1 mol·L-1 NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈___(填“酸”“碱”或“中”)性,其原因是____________(用离子方程式表示)。
(2)比较溶液②③中c (NH4+)②____________③(填“>”、“<”或“=”)
(3)在溶液④中,___的浓度为0.1 mol·L-1(填选项);NH3·H2O和_____离子的浓度之和为0.2 mol·L-1。(填选项)
A .c (NH4+) B. c (Cl-)
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度___NH4+的水解程度,(填“>”“<”或“=”),c(CH3COO-)_____ c(NH4+) (填“>”“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CH4 是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3kJ·mol-1。它可以作为燃料电池的燃料。
(1)写出甲烷燃烧的热化学方程式:____________________________________________;
(2)以甲烷、空气、氢氧化钾溶液为原料,惰性电极为电极可以构成燃料电池。该电池的负极反应式为____
(3)用(2)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,装置如图所示:
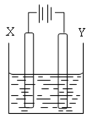
①请写出电解过程中阴极附近观察到的现象:____________________。
②当燃料电池消耗2.8L O2(标准状况下)时,计算此时NaCl溶液的pH=__________ (假设溶液的体积不变,气体全部从溶液中逸出)。在Y极通过的电子的物质的量为:_______________________。
③电解之后,要使溶液恢复原状,应该向溶液中加入物质 _________(填名称)。溶液中Cl―流向 ____________极(填“X”或“Y”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是 ,形成白雾的原因是 。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
通过该实验说明现象ⅱ中黄色气体含有 。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
① 实验b检出的气体使之变蓝,反应的离子方程式是________________。实验证实推测成立。
② 溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是 。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ 。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是 。
②方案2中检验Fe2+ 的原因是 。
③综合方案1、2的现象,说明选择NaBr溶液的依据是 。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com