
科目: 来源: 题型:
【题目】某项目学习小组在实验失室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。已知:
①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱的反应为放热反应.温度较高时,氯气和碱还能发生如下反应:3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O。
5Cl-+ClO3-+3H2O。
该项目小组设计了下列实验装置,进行实验。
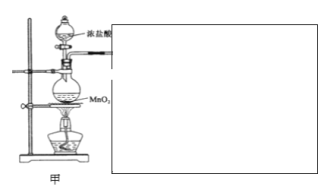
请回答下列问题:
(1)甲装置用于制备氯气。
①请你将装置在图中方框中补充完整___(并标明所加药品)
②该项目小组用100mL12mol/L盐酸与8.7gMnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2的物质的量为___。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,原因有二:
①部分氯气未与石灰乳反应而逸出;
②___。
(3)为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图(不考虑氯气和水的反应)。
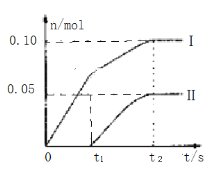
①图中曲线I表示___离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为___。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中![]() =___(填比值)。
=___(填比值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是( )

氯化钠 (NaCl) | ≥98.0% (以NaCl计) |
碘酸钾 (KIO3) | (35±15)mg/kg (以I计) |
A.此食盐是纯净物
B.“加碘食盐”中的“碘”是指单质
C.1kg此食盐中含碘酸钾(35±15)mg
D.菜未烧熟不宜加入加碘的原因可能是碘酸钾受热不稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】某项目小组同学发现某一种胃药片的止酸剂为碳酸钙,为了测定其中止酸剂的质量特制定了如下操作步骤:
①配制0.2mol·L-1的HCl溶液和0.2mol·L-1的NaOH溶液;②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后放入锥形瓶中再加入20mL蒸馏水;③以酚酞作指示剂,用0.2mol·L-1的NaOH溶液滴定,需用去VmL达滴定终点;④加入25mL0.2mol·L-1的HCl溶液。
(1)写出全部实验过程的操作步骤的顺序:__。
(2)如图所示的仪器中配制0.2mol·L-1的HCl溶液和0.2mol·L-1NaOH溶液肯定不需要的仪器是__(填序号),配制上述溶液还需用到的玻璃仪器是__(填仪器名称)。

(3)配制上述溶液应选用的容量瓶的规格分别为__(填字母)。
A.50mL、50mL B.100mL、100mL
C.100mL、150mL D.250mL、250mL
(4)配制过程中,下列情况会使配制结果偏高的是__(填序号)。
A.洗净后容量瓶内还残留蒸馏水未烘干
B.量取浓盐酸时,仰视刻度线观察液面
C.定容时,仰视刻度线
D.定容后,加盖倒转摇匀后,发现液面低于刻度线又加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 盐酸和氨水反应H++OH=H2O、B. 钠和冷水反应Na+2H2O=Na++2OH+H2↑
C. 氯气和氢氧化钠溶液反应Cl2+2OH=Cl+ClO+H2OD. 铜和稀硝酸反应Cu+2NO3+4H+=2Cu2++2NO2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是原子序数依次增大的前四周期元素。
是原子序数依次增大的前四周期元素。![]() 是宇宙中最丰富的元素;
是宇宙中最丰富的元素;![]() 元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子;向含
元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子;向含![]() 的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液。回答下列问题:
的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液。回答下列问题:
(1)第一电离能![]() ____
____![]() ,电负性
,电负性![]() ____
____![]() (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
(2)写出与![]() 分子互为等电子体的一种离子的化学式_________。
分子互为等电子体的一种离子的化学式_________。
(3)若向含有![]() 的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有____________色晶体析出,该晶体中,中心离子的电子排布式为____________,配体为____________。
的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有____________色晶体析出,该晶体中,中心离子的电子排布式为____________,配体为____________。
(4)已知![]() 形成的一组二元化合物化学式:
形成的一组二元化合物化学式:![]() 、
、![]() 、
、![]() 、
、![]() 其中,
其中,![]() 分子中
分子中![]() 原子的杂化类型为___________;这组化合物的通式为________________。
原子的杂化类型为___________;这组化合物的通式为________________。
(5)已知![]() 和
和![]() 可以形成
可以形成![]() 和
和![]() 两种化合物,试根据有关信息完成下列问题:
两种化合物,试根据有关信息完成下列问题:
①用球棍模型表示的![]() 分子结构是_______________。
分子结构是_______________。
A.![]() B.
B.![]() C.
C.![]() D.
D.
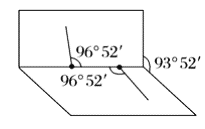
②已知![]() 子的结构如图所示:
子的结构如图所示:![]() 分子不是直线形的,两个
分子不是直线形的,两个![]() 原子犹如在半展开的书的两面上,两个
原子犹如在半展开的书的两面上,两个![]() 原子在书脊位置上,书页夹角为
原子在书脊位置上,书页夹角为![]() ,而
,而![]() 键与
键与![]() 键的夹角均为
键的夹角均为![]() 。则
。则![]() 子的电子式为_________,结构式为_________,
子的电子式为_________,结构式为_________,![]() 分子是_______(填“极性”或“非极性”)分子。
分子是_______(填“极性”或“非极性”)分子。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知氧化性:BrO3->IO3->Br2>I2。向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加KBrO3的物质的量的关系如图所示。请回答下列问题:
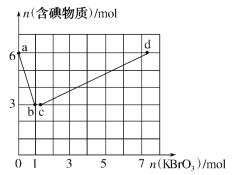
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为__,还原产物是__。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式___。
(3)①已知反应:2BrO3-+I2→2IO3-+Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确___,并说明理由:___。
(4)计算c→d过程中消耗KBrO3的物质的量___。(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B |
|
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)![]() 原子的核外电子排布式:___________________。
原子的核外电子排布式:___________________。
(2)![]() 元素在元素周期表中的位置________;离子半径:
元素在元素周期表中的位置________;离子半径:![]() ____
____![]() (填“大于”或“小于”)
(填“大于”或“小于”)
(3)![]() 原子的电子排布图是______,能量最高的电子为______轨道上的电子,其轨道呈______形。
原子的电子排布图是______,能量最高的电子为______轨道上的电子,其轨道呈______形。
(4)![]() 的结构示意图是________________。
的结构示意图是________________。
(5)![]() 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与![]() 的最高价氧化物对应的水化物反应的化学方程式为________,与
的最高价氧化物对应的水化物反应的化学方程式为________,与![]() 最高价氧化物对应的水化物反应的化学方程式为________________。
最高价氧化物对应的水化物反应的化学方程式为________________。
(6)举一实例说明![]() 元素的非金属性比
元素的非金属性比![]() 元素的强_______________
元素的强_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)![]() 分子的晶体中,在晶胞的顶点和面心均含有一个
分子的晶体中,在晶胞的顶点和面心均含有一个![]() 分子,则一个
分子,则一个![]() 晶胞的质量为_______。
晶胞的质量为_______。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是_____(填字母)。
a.晶体的熔点:干冰>冰
b.晶体中的空间利用率:干冰>冰
c.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的是______(填字母)。
a.金刚石中碳原子的杂化类型为![]() 杂化,石墨中碳原子的杂化类型为
杂化,石墨中碳原子的杂化类型为![]() 杂化
杂化
b.晶体中共价键的键长:金刚石中![]() <石墨中
<石墨中![]()
C.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
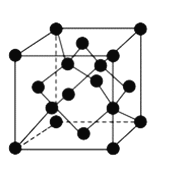
(4)金刚石晶胞结构如下图,立方![]() 结构与金刚石相似,在
结构与金刚石相似,在![]() 晶体中,
晶体中,![]() 原子周围最近的
原子周围最近的![]() 原子所构成的立体图形为_______,
原子所构成的立体图形为_______,![]() 原子与
原子与![]() 原子之间共价键与配位键的数目比为_______,一个晶胞中
原子之间共价键与配位键的数目比为_______,一个晶胞中![]() 原子数目为___________。
原子数目为___________。
(5)已知![]() 单质的晶体密度为
单质的晶体密度为![]() ,
,![]() 的相对原子质量为
的相对原子质量为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则
,则![]() 的原子半径为_________。
的原子半径为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ下图为几种晶体或晶胞的示意图:
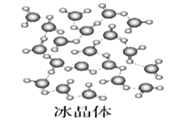
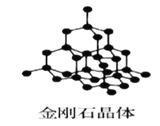
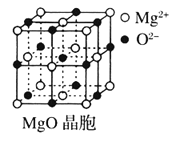
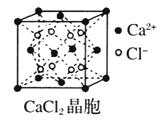

请回答下列问题:
(1)上述晶体中,粒子之间仅以共价键结合形成的晶体是____________。
(2)冰、金刚石、![]() 、
、![]() 、干冰5种晶体的熔点由高到低的顺序为_________________。
、干冰5种晶体的熔点由高到低的顺序为_________________。
(3)![]() 晶胞与
晶胞与![]() 晶胞相同,
晶胞相同,![]() 晶体的晶格能______(填“大于”或“小于”)
晶体的晶格能______(填“大于”或“小于”)![]() 晶体,原因是_________________。
晶体,原因是_________________。
(4)![]() 晶体中
晶体中![]() 的配位数为____________。
的配位数为____________。
(5)冰的熔点远高于干冰,除![]() 是极性分子、
是极性分子、![]() 是非极性分子外,还有一个重要的原因是__________________。
是非极性分子外,还有一个重要的原因是__________________。
Ⅱ(1)原子坐标参数可表示晶胞内部各原子的相对位置,金属钾是体心立方晶系,其构型如图。其中原子坐标参数![]() 、
、![]() ,则
,则![]() 原子的坐标参数为________________。
原子的坐标参数为________________。
(2)钾晶体的晶胞参数为![]() 。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为_____
。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为_____![]() ,晶体钾的密度计算式是_____
,晶体钾的密度计算式是_____![]() 。
。

查看答案和解析>>
科目: 来源: 题型:
【题目】硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:下列叙述正确的是
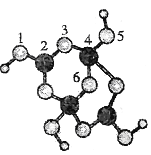
A.Xm-的化学式为B4O8H42-
B.硼原子轨道的杂化类型有sp2、 sp3
C.配位键存在于4、6原子之间
D.硼砂晶体中有离子键、配位键两种化学键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com