
科目: 来源: 题型:
【题目】磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
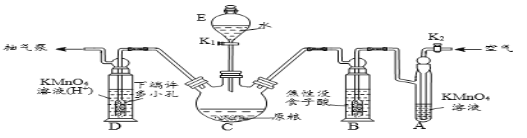
(操作流程)安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
(实验装置)C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol L-1KMnO4溶(H2SO4酸化)。
(1)仪器C的名称是_________;原粮最好先打成粉末,其原因是_____________。
(2)磷化钙与水反应化学方程式为_____________________________________;检查整套装置气密性良好的方法是_______________________________________。
(3)A中盛装KMnO4溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止___________;通入空气的作用是____________。
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,写出该反应的离子方程式________________,消耗标Na2SO3准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg kg-1。
(6)滴定结束的现象_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)
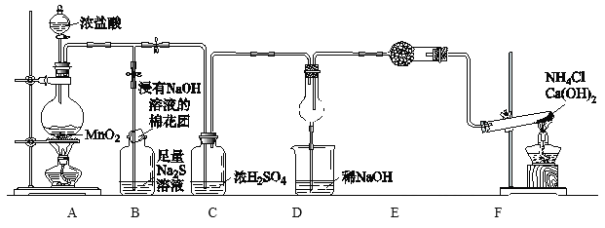
(1)写出A中反应的离子方程式___________________________。
(2)写出F中反应的化学方程式_________________________。
(3)B中浸有NaOH溶液的棉花作用___________________,B中溶液出现现象_______________,写出B中发生的离子反应_________________。
(4)E中干燥管装的干燥剂是________,检验F中气体的方法______________。
(5)D中干燥管中出现的现象______________,D中干燥管中化学方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为__________,其中氮的化合价为______。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的离子方程式____________。
(3)联氨和N2O4可作为火箭推进剂,其反应的产物均无污染。其氧化产物和还原产物之比为 _______。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似。联氨与硫酸形成的酸式盐的化学式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。请回答下列问题:
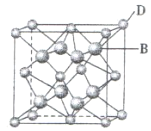
(1)C原子基态时的电子排布式为_______________,元素A、B、C、F的原子半径由大到小的顺序_________。
(2)A2F的分子空间构型为_______________,FO3分子中F原子的杂化方式______________。
(3)从图中可以看出,D 与B形成的离子化合物的化学式为__________(用元素符号表示),该离子晶体的密度为ag·cm-3,则晶胞的体积是_________(写出表达式即可,不用化简)。
(4)已知E单质的晶体为面心立方最密堆积 (在晶胞的顶点和面心均含有一个E原子),则E的晶体中E原子的配位数为________。
(5)氮化硼(BN)是一种重要的功能陶瓷材料,其晶胞结构如图所示。请回答下列问题:
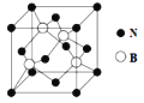
B和N相比,电负性较大的是_________,氮化硼的晶体类型______,氮化硼的晶胞中有几个氮原子_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的镁铜合金加入到100 mL某浓度HNO3中,两者恰好反应,假设反应的还原产物只有NO气体。反应后向所得溶液中加入物质的量浓度为3 mol/L的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g;则下列有关叙述中不正确的是( )
A.开始加入合金的总物质的量为0.15 mol
B.生成NO气体体积在标准状况下为2.24 L
C.生成沉淀完全时消耗NaOH溶液体积为100 mL
D.参加反应的硝酸的物质的量浓度为1 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】密闭容器中, xA(g)+yB(g)![]() zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
zC(g)达平衡时A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,A的浓度为0.30mol/L。下列说法正确的是
A.平衡向正反应方向移动 B.x+y<z
C.B的转化率升高 D.C的体积分数下降
查看答案和解析>>
科目: 来源: 题型:
【题目】将9.0 g铜和铁的混合物投入100 mL稀硝酸中并加热,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是 ( )
A.原混合物中铜和铁的物质的量均为0.075 mol
B.反应前稀硝酸的物质的量浓度无法计算
C.若向上述最后所得溶液中再加入足量稀硝酸,还可得到标准状况下1.12 L NO
D.第一次与100 mL稀硝酸反应后剩余的4.8 g金属为铜和铁
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是 ( )
A.向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中,溶液中的HCO3-浓度变化是先变大后变小(溶液体积变化均忽略不计)
B.向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化是先变大后变小(溶液体积变化均忽略不计)
C.将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是:a=b
D.有含0.2 mol Na2CO3和含0.3 mol HCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中;①②两种操作生成的CO2体积之比为3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com