
科目: 来源: 题型:
【题目】芘经氧化后可进一步用于染料合成。芘的一种转化路线如图:
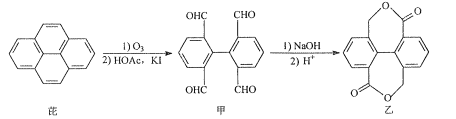
下列叙述正确的是( )
A.芘的分子式为C16H10
B.甲分子中所有碳原子一定都在同平面上
C.甲在一定条件下可发生加成反应和银镜反应
D.1mol乙与足量NaOH溶液反应,最多消耗4molNaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)钙钛型复合氧化物可用于制造航母中的热敏传感器,其晶胞结构如图所示,其中A为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有好的电学性能。下列说法正确的是_____ (填序号)。
A.金属Ca、Sr、Ba采用体心立方堆积
B.用A、B、O表示的钙钛型复合氧化物晶体的化学式为ABO3
C.在制造Fe薄片时,金属键完全断裂
D.V、Cr、Mn、Fe晶体中均存在金属阳离子和阴离子

(2)辽宁号航母飞行甲板等都是由铁及其合金制造的。铁有δ、γ、α三种同素异形体,其晶胞结构如图所示。
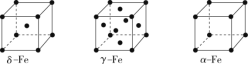
①γ—Fe晶胞中含有的铁原子数为_____。—
②δ—Fe、α—Fe两种晶体中铁原子的配位数之比为_____。
③若α—Fe晶胞的边长为acm,γ—Fe晶胞的边长为bcm,则两种晶体的密度之比为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年度诺贝尔化学奖授予在锂离子电池发展做出贡献的三位科学家。某浓差电池的原理示意如图所示,可用该电池从浓缩海水中提取LiCl溶液。下列有关该电池的说法不正确的是( )
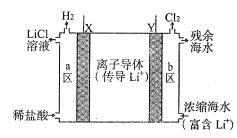
A.该装置可在提取LiCl溶液的同时得电能
B.电子由Y极通过外电路移向X极
C.正极发生的反应为:2H++2e—===H2↑
D.Y极每生成22.4LCl2,有2molLi+从b区移至a区
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____,中心原子的杂化类型为_____。
(2)CS2分子中,C原子的杂化轨道类型是_____。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_____,其中氧原子的杂化方式为_____。
(4)CH3COOH中C原子轨道杂化类型为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.Cu2(OH)2CO3(s)![]() CuCl2(aq)
CuCl2(aq)![]() Cu(s)
Cu(s)
B.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
C.Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() FeCl3(aq)
FeCl3(aq)
D.SiO2(s)![]() SiCl4(l)
SiCl4(l)![]() Si(s)
Si(s)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.NO2溶于水:3NO2+H2O=2H++2NO3-+NO
B.电解饱和食盐水:2Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
C.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
D.向氨水中通入过量CO2:2NH3·H2O+CO2=2NH4++CO32-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.澄清透明的酸性溶液中:Fe3+、Cu2+、SCN-、SO42-
B.能使酚酞变红的溶液中:K+、NH4+、Cl-、NO3-
C.![]() =10-12mol·L-1的溶液中Na+、Al3+、Cl-、SO42-
=10-12mol·L-1的溶液中Na+、Al3+、Cl-、SO42-
D.c(HCO3-)=0.1mol·L-1的溶液中:H+、Mg2+、SO42-、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中采用废铁屑来制备硫酸铁铵[NH4Fe(SO4)2·xH2O]的具体流程如图:
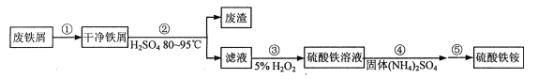
(1)步骤①中通常加入热的碳酸钠溶液,其目的是__。
(2)步骤②需要加热的目的是___。铁屑中含少量硫化物,反应产生的气体可用图1所示装置进行净化处理,X溶液为___(填字母)。
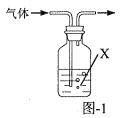
A.蒸馏水 B.饱和食盐水 C.NaOH溶液 D.稀HNO3
(3)步骤③中,要保持溶液的pH<0.5的原因是___。
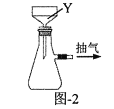
(4)步骤⑤包含抽滤操作(如图-2所示),仪器Y的名称为__。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列有机物的类别及所含官能团的名称。
(1)CH3CH=CH2____、_________;
(2)HC≡C—CH2CH3__________、__________;
(3)![]() _________、___________;
_________、___________;
(4)![]() _________、_________;
_________、_________;
(5)![]() _________、___________;
_________、___________;
(6)CH3CH2—O—CH3__________、__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了_____的作用力;二氧化硅熔化,粒子间克服了_____的作用力;碘的升华,粒子间克服了_____的作用力。三种晶体的熔点由高到低的顺序是_____。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为_____ (填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,五种物质的熔点由高到低的顺序是_____。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500℃
试推断它们的晶体类型:A_____;B_____;C_____;D_____。
(5)如图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A_____;B_____;C_____;D_____。
A.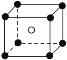 B.
B.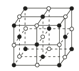 C.
C.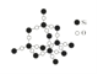 D.
D.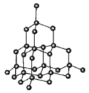
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com