
科目: 来源: 题型:
【题目】化合物F是合成心脏病治疗药法西多曲的中间体,其合成路线流程图如图:
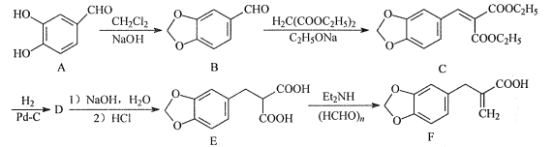
(1)C中的含氧官能团名称为___和___。
(2)A-B的反应类型为___。
(3)D的分子式为C15H18O6,写出D的结构简式:___。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
①能与FeCl3溶液发生显色反应,不能发生银镜反应;
②苯环上有4个取代基,分子中只有4种不同化学环境的氢。
(5)请写出以H2C=CH2、H2C(COOC2H5)2、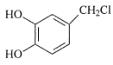 为原料制备
为原料制备 的合成路线流程图___(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图___(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解饱和食盐水时,下列叙述正确的是
A.正极产生氯气,负极产生氢气B.阳极得到的气体能使碘化钾溶液变蓝
C.在阳极区滴入酚酞试液,溶液显红色D.阳极得到氯气,阴极得到钠
查看答案和解析>>
科目: 来源: 题型:
【题目】以下对于溶液中一些成分的鉴定,正确的是
A.取少量待测液于试管中,滴加少量的NaOH溶液,若出现白色絮状,则说明待测液中含有![]()
B.取少量待测液于试管中,滴加少量的KSCN溶液,若出现血红色,则说明待测液中不含Fe元素
C.取少量待测液于试管中,滴加少量的![]() 溶液,若出现白色絮状,则说明待测液中含有
溶液,若出现白色絮状,则说明待测液中含有![]()
D.取少量待测液于试管中,滴加少量的NaOH溶液,若出现气泡,则说明待测液中含有![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)=N2O4(g) 达到平衡。其它条件不变时,下列措施:
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
能提高NO2转化率的是_______(填字母)。
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O (l) ,放出19.14kJ
的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O (l)的△H=______kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g)![]() N2O4(g)的平衡常数K=______。
N2O4(g)的平衡常数K=______。
(4)现用一定量的Cu 与足量的浓HNO3反应,制得1.00L已达平衡的N2O4和NO2
混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu的质量是________。
查看答案和解析>>
科目: 来源: 题型:
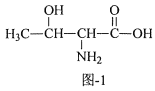
【题目】配合物X{[Cu(phen)(Thr)(H2O)]ClO4}能够通过插入或部分插入的模式与DNA作用,它可由Cu(ClO4)2、HThr(结构简式如图l所示)、phen等为原料制备。
(1)Cu2+基态电子排布式为___。
(2)ClO4-的空间构型为__(用文字描述),与ClO4-互为等电子体的一种分子的化学式为___。
(3)HThr分子中,碳原子的杂化类型为___;1molHThr中含有σ键的数目为___。
(4)配合物X中配离子的结构如图2所示,则配位原子为___(填元素符号)。

查看答案和解析>>
科目: 来源: 题型:
【题目】工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。某教师在指导学生做研究性学习时,拟利用废铁屑在实验室制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备补血剂硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O,相对分子质量为392]。硫酸亚铁铵晶体比一般亚铁盐稳定,在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)废铁屑的净化:将废铁屑投入10%的碳酸钠溶液中并加热5~10min,通过倾析法弃去纯碱溶液,并用蒸馏水洗净废铁屑,待用。
(2)酸浸净化后的废铁屑:将2gFe粉、10mL3mol·L-1的H2SO4溶液加入烧瓶中反应,用如图所示装置制备FeSO4溶液。保持温度70~80℃,适当添加水以补充被蒸发掉的水分,并控制溶液的pH,至反应无明显气泡产生,停止加热,过滤,称量残留固体质量。
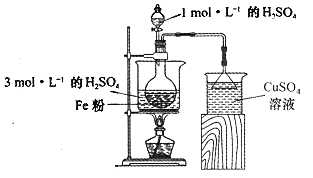
①反应过程中会产生少量H2S、PH3等气体,需使用封闭装置。写出用CuSO4溶液吸收H2S气体的化学反应方程式:____________________________
②反应过程中使用过量铁粉的目的是____________________________
(3)制备(NH4)2Fe(SO4)2·6H2O:向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。
实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是_____ (填序号)。
A.通入过量Cl2:Fe2+、H+、NH4+、Clˉ、SO42ˉ
B.加入过量KSCN溶液:K+、NH4+、Fe3+、SO42ˉ、SCNˉ
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42ˉ、OHˉ
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42ˉ、Clˉ、ClOˉ、OHˉ
(4)产品纯度测定:称取ag产品溶于水,配制成500mL溶液,取25.00mL待测液,用浓度为cmol·L-1的酸性KMnO4溶液滴定。重复上述操作2次实验结果如下:

该产品的纯度为____________________________(用含a、c的代数式表示)。
有同学提出,测定产品中SO42ˉ的含量也可测定产品的纯度,请补充完整实验方案:称取约0.4g样品,溶于70mL水,__________________________________________________,将沉淀移入坩埚,灼烧至恒重,记录数据(实验中必须使用的试剂有:2mol·L-1的HCl溶液、BaCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铅蓄电池的充放电反应为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。
2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。
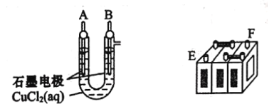
(1)将A接E、B接F,B电极出现_____________现象,电极反应式为_____________,说明F为正极。
(2)铅蓄电池工作时(放电),E电极的反应式为_____________,充电时该极与外接电源的_____________极相连。
(3)若有0.2mol电子发生转移,则正极消耗PbO2的物质的量是______mol。
(4)如图是在金属锌板上贴上一张用某溶液浸湿的滤纸。
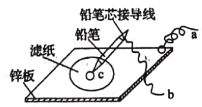
①若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现____色,铅笔芯c点处的电极反应式为________________。
②若用KI-淀粉溶液浸湿滤纸,用导线将a、b与铅蓄电池的E、F电极相连,铅笔芯c点处出现蓝色,则b接的是_______(填“E”或“F”)电极。
查看答案和解析>>
科目: 来源: 题型:
【题目】烟气脱硫后的物质可以再生、再利用。
(1)一种干法脱硫技术以CuO为吸收荆,并用CH4再生CuO,原理如下:
2CuO(s)+2SO2(g)+O2(g)=2CuSO4(s) ΔH1=akJ·mol-1
2CuSO4(s)+CH4(g)=2Cu(s)+2SO2(g)+CO2(g)+2H2O(l) ΔH2=bkJ·mol-1
2Cu(s)+O2(g)=2CuO(s) ΔH3=ckJ·mol-1
反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的ΔH=___kJ·mol-1(用含a、b、c的代数式表示)。
(2)钠碱法脱硫后的吸收液中主要成分为NaHSO3、Na2SO3。用三室阴阳膜组合膜电解吸收液可再生得到Na2SO3,原理如图1所示。
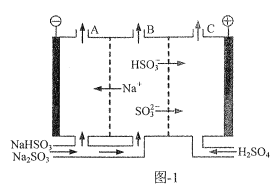
①写出电解时HSO3-在阳极发生反应的电极反应式:___。
②电解时采用吸收液低流速通过阴极的原因为___。
③如将阴离子交换膜电换成阳离子交换膜,则出口B溶液中的溶质主要是(填化学式)___。
(3)循环流化床烟气脱硫灰的主要成分有CaCO3、CaSO3·0.5H2O、CaSO3、CaSO4。为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如图所示。
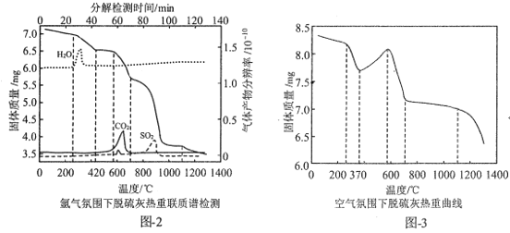
①图2中,1100℃时,残留固体主要成分为___;在600-630℃时有一个微弱的SO2峰,可能是由于脱硫灰中少最的FeSO4分解导致的,写出该分解反应的化学方程式:___。
②对比图2与图3知,图3中370—42℃曲线上升的原因为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下气体反应达到化学平衡,平衡常数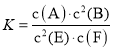 。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
A.恒容时,向容器中充入稀有气体,反应速率不变
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s)A(g)+2B(g)
D.正反应为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com