
科目: 来源: 题型:
【题目】硫酸镍(NiSO4)是电镀镍工业所用的主要镍盐,易溶于水。下图为某兴趣小组设计的在实验室中
制备 NiSO46H2O 的装置。
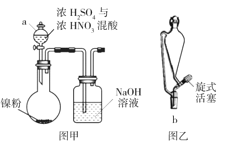
回答下列问题:
(1)实验室中配制浓 H2SO4 与浓 HNO3 混酸的操作为______。
(2)图甲中仪器 a 的名称为__________,有同学认为将仪器 a 换作图乙中的仪器 b 效果更好,其理由 为______。
(3)混酸与镍粉反应时,除生成 NiSO4 外,还生成了 NO2、NO 和 H2O,若 NO2 与 NO 的物质的量之比为 1∶1,则该反应的化学方程式为______。从反应后的溶液中得到 NiSO46H2O 的操作有_____和过滤、洗涤、干燥。
(4)该小组同学查阅资料发现用镍粉与混酸制备 NiSO4 成本高,用冶铁尾矿提取的草酸镍(NiC2O4)与硫酸制取 NiSO4 成本较低。反应原理为:NiC2O4![]() NiO+CO↑+CO2↑,NiO+H2SO4===NiSO4+H2O(已知 PdCl2溶液能够吸收 CO)。现加热 NiC2O4 制备 NiO,并检验生成的 CO,可能用到的装置如下:
NiO+CO↑+CO2↑,NiO+H2SO4===NiSO4+H2O(已知 PdCl2溶液能够吸收 CO)。现加热 NiC2O4 制备 NiO,并检验生成的 CO,可能用到的装置如下:
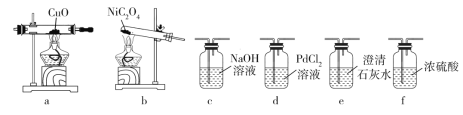
①各装置的连接顺序为:_____→______→_______→ f →_____→_____→_____。(填装置 标号,可重复使用)
②能够说明生成 CO 的现象有______。
③PdCl2 溶液吸收 CO 时产生黑色金属单质和 CO2 气体,该反应其他产物的化学式为______________________。
(5)将 NiSO46H2O 制成电镀液时往往加入少量稀硫酸,其目的是___________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】据预测,到2040年我国煤炭消费仍将占能源结构的三分之一左右。H2S在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述错误的是
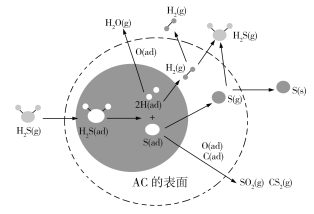
A. 图中阴影部分表示H2S分子的吸附与离解
B. AC表面作用的温度不同,H2S的去除率不同
C. H2S在AC表面作用生成的产物有H2O、H2、S、SO2、CS2等
D. 图中反应过程中只有H—S键的断裂,没有H—S键的形成
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,现有浓度均为0.10mol/L的三种溶液:①NaCl溶液、②CH3COONa溶液、③CH3COOH溶液。请回答:
(1)三种溶液中,pH>7的是__________(填序号),其原因是________________________________________(用离子方程式表示)。pH<7的是__________(填序号),其原因是________________________________________(用化学用语表示)。
(2)下列说法正确的是__________(填序号)。
a.CH3COONa是弱电解质
b.CH3COONa和CH3COOH都能促进水的电离
c.①②两种溶液等体积混合后,溶液中c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-)
(3)②③两种溶液等体积混合后,溶液pH<7,该混合溶液中离子浓度大小关系是_____________________
(4) 25℃时,电解1.00L饱和NaCl溶液一段时间后,收集到1.12LH2(标准状况)。该反应的离子方程式是____________,此时溶液的pH是____________(不考虑溶液体积的变化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】
氮原子可以形成 σ 键、π 键、大 π 键和配位键,成键的多样性使其形成了多种具有独特组成的物质。回答下 列问题:
(1)第一电离能:氮______氧(填“大于”或“小于”),基态氮原子价电子排布图不是![]() ,是因 为该排布方式违背了__________。
,是因 为该排布方式违背了__________。
(2)肼(H2NNH2)分子中孤电子对与 σ 键的数目之比为______,肼的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是______。
( 3)硝酸的结构可表 示 为 ![]() ,硝酸与水分子可 形 成一水合二硝酸结晶 水 合物 (2HNO3 H2O) , 水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式______(氢键用“…”表示)。
,硝酸与水分子可 形 成一水合二硝酸结晶 水 合物 (2HNO3 H2O) , 水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式______(氢键用“…”表示)。
(4)正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
①Na3NO4 阴离子的空间构型为______,其中心原子杂化方式为______。
②分别写出一种与 Na3NO4 的阴离子互为等电子体的阴离子和分子______(填化学式)。
③在 573 K 条件下,实验室中用 NaNO3 和 Na2O 在银皿中反应制得 Na3NO4,Na2O 的立方晶胞如图所 示。

图中“●”表示______(填“Na+”或“O2”),距离“●”最近且等距离的“○”有______个,Na2O 晶胞的参数为 a pm,则晶胞密度为_____gcm3。(列出计算式即可,NA 为阿伏加德罗常数的值)
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10mol/LNa2S2O3溶液与0.10mol/L 稀H2SO4反应速率的影响。反应方程式为:Na2S2O3 +H2SO4=Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 甲/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | A | 10.0 | y |
③ | 0 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为____________,乙是实验需要测量的物理量,则表格中“乙”为____________,x、y、z的大小关系是____________。
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g)+3H2(g)=2NH3(g).
①已知:
化学键 | H-H | N≡N | N-H |
键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是________________________________________。
②若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,达到平衡时NH3浓度的范围是____________________。
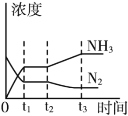
③如图表示该反应在t1时刻达到化学平衡,在t2时因改变某个条件而发生变化的情况,则t2时刻改变条件可能是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是
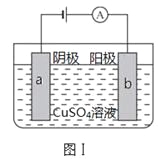
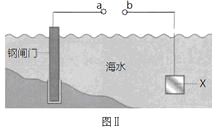
A.图Ⅰ中a为纯铜
B.图Ⅰ中SO42—向b极移动
C.图Ⅱ中如果a、b间连接电源,则a连接负极
D.图Ⅱ中如果a、b间用导线连接,则X可以是铜
查看答案和解析>>
科目: 来源: 题型:
【题目】(11分)甲烷水蒸气催化重整(SMR)是传统制取富氢混合气的重要方法,具有工艺简单、成本低等优点。回答下列问题:
(1)已知1000 K时,下列反应的平衡常数和反应热:
①CH4(g) ![]() C(s)+2H2(g) K1=10.2 ΔH1
C(s)+2H2(g) K1=10.2 ΔH1
②2CO(g) ![]() C(s)+CO2(g) K2=0.6 ΔH2
C(s)+CO2(g) K2=0.6 ΔH2
③CO(g)+H2O(g) ![]() CO2(g)+H2(g) K3=1.4 ΔH3
CO2(g)+H2(g) K3=1.4 ΔH3
④CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g) K4 ΔH4(SMR)则1000 K时,K4=____________;ΔH4=_________(用ΔH1、ΔH2、ΔH3来表示)。
CO2(g)+4H2(g) K4 ΔH4(SMR)则1000 K时,K4=____________;ΔH4=_________(用ΔH1、ΔH2、ΔH3来表示)。
(2)在进入催化重整装置前,先要对原料气进行脱硫操作,使其浓度为0.5 ppm以下。脱硫的目的为______________。
(3)下图为不同温度条件下电流强度对CH4转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知ΔH4____0(填“>”或“<”)。
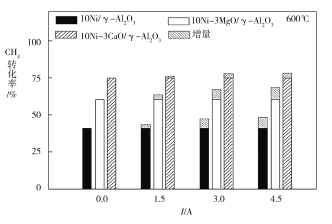
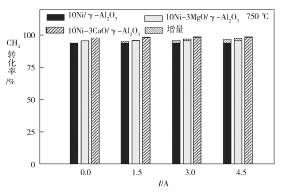
(4)下图为不同温度条件下6小时稳定测试电流强度对H2产率的影响。由图可知,随着温度的降低,电流对H2产率的影响作用逐渐____________(填“增加”“减小”或“不变”),600 ℃时,电流对三种催化剂中的____________(用图中的催化剂表示式回答)影响效果最为显著,当温度高于750 ℃时,无论电流强度大小,有无催化剂,H2产率趋于相同,其原因是______________。

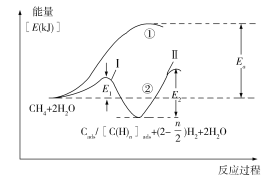
(5)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→Cads/[C(H)n]ads+(2–![]() )H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+
)H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+![]() )H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①_______②(填“>”“<”或“=”);控制整个过程②反应速率的是第_______步,其原因为____________________________。
)H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①_______②(填“>”“<”或“=”);控制整个过程②反应速率的是第_______步,其原因为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOH![]() H++CH3COO,下列叙述不正确的是
H++CH3COO,下列叙述不正确的是
A.升高温度,平衡正向移动,醋酸的电离常数Ka增大
B.0.10 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)增大。
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸。
查看答案和解析>>
科目: 来源: 题型:
【题目】蔗糖与浓硫酸反应的实验改进装置如图所示,下列说法错误的是
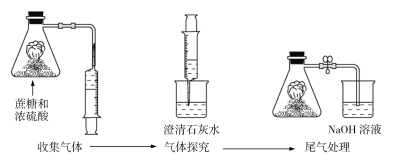
A.改进装置后,有毒气体被碱液吸收,实现了绿色环保
B.浓硫酸在实验过程中体现了脱水性和强氧化性
C.产生的气体能使澄清石灰水变浑浊,说明产生了CO2
D.该反应比较剧烈、危险,实验各物质的用量应按要求规范操作
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,水中存在电离平衡:H2O ![]() H++OH-△H>0。下列叙述正确的是
H++OH-△H>0。下列叙述正确的是
A.将水加热,Kw增大,pH不变
B.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低
C.向水中加入少量NH4Cl固体,平衡正向移动,溶液呈碱性
D.向0.1mol/L的醋酸溶液中加入一定量醋酸钠晶体,溶液中c(OH-)增大,Kw不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com