
科目: 来源: 题型:
【题目】硫及其化合物有许多用途。相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______,基态S原子电子占据最高能级的电子云轮廓图为______形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____。
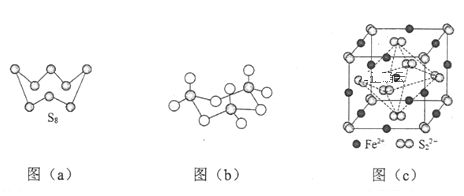
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为______。
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数___________,晶胞边长为anm,FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____g/cm3.(写出表达式) ;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目: 来源: 题型:
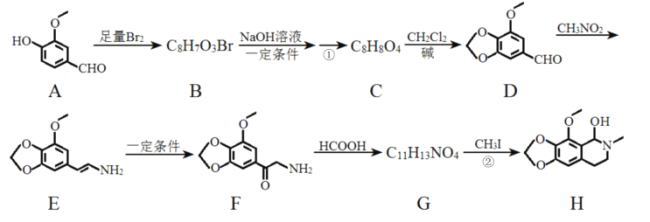
【题目】那可丁是一种药物,为支气管解痉性镇咳药,能解除支气管平滑肌痉挛,抑制肺牵张反射引起的咳嗽,化合物H是制备该药物的重要中间体,合成路线如图:
已知:
a.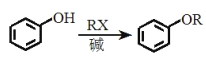 ;
;
b.RNH2![]() RNHCH3。
RNHCH3。
(1)反应①的条件为__。
(2)反应②的反应类型为__。
(3)化合物G的结构简式为__。
(4)下列说法正确的是__。
a.物质D能与FeCl3发生显色反应
b.物质F具有碱性
c.物质G能和银氨溶液发生反应
d.物质H的分子式是C12H15NO4
(5)写出C→D的化学方程式:__。
(6)满足下列条件,化合物A所有同分异构体有__种(不包括A)。
①可以与活波金属反应生成氢气,但不与NaHCO3溶液反应;
②分子中含有![]() 结构;
结构;
③含有苯环,且有两个取代基。
(7)已知CH2=CHCH3![]() CH2=CHCH2Cl,请以
CH2=CHCH2Cl,请以![]() 、CH3CHClCH3为原料合成化合物
、CH3CHClCH3为原料合成化合物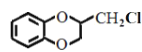 ,写出制备的合成路线流程图(无机试剂任选)__。
,写出制备的合成路线流程图(无机试剂任选)__。
查看答案和解析>>
科目: 来源: 题型:
【题目】“84”消毒液、医用酒精等能对新冠病毒进行有效消杀。某兴趣小组在实验室自制“84”消毒液。请回答以下问题:
(1)“84”消毒液消杀新冠病毒的原理是__。
(2)甲同学设计图1所示实验装置(夹持装置省略)制取“84”消毒液。
①B中的试剂是__。
②干燥管的作用是__。
③当C中NaOH溶液吸收完全后,停止通氯气,检验氯气已过量的方法为__。
(3)乙同学设计图2所示电解装置制取“84”消毒液。
①铁电极作__极。
②该电解制取NaClO的总反应的化学方程式为__。
③充分电解后,为检验电解液中是否还残留少量Cl-,取少量电解后溶液于试管中,滴加AgNO3溶液,试管中产生白色沉淀并有无色气体产生,该气体能使带火星的木条复燃。试管中发生反应的离子方程式为___。
④取25.00mL电解后溶液,加入过量KI与稀硫酸混合溶液,充分反应后加入2滴淀粉液,用0.1000molL-1Na2S2O3溶液滴定,消耗12.00mL。则该电解液有效氯(以有效氯元素的质量计算)的浓度为___mg/L。(已知:2S2O32-+I2═S4O62-+2I-)
(4)与甲同学制法相比,乙同学制法的优点除了有装置与操作简单外还有:__、__(请列举出两种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素,回答下列问题:
(1)Zn2+原子核外电子排布式为_______________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)______I1(Cu)填“大于”或“小于”)。原因是_______________________________。
(3)ZnF2具有较高的熔点(872℃),其化学键类型是______,ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是_____________________________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为______,C原子的杂化形式为___________________。
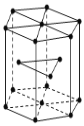
(5)金属Zn晶体中这种堆积方式称为_______________。该晶胞中含有的微粒个数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu、Zn及其化合物在生产、生活中有着重要作用。
(1)Cu、Zn在周期表中__区,焰色反应时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式_。
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因是__。
②溶液中的水存在H3O+、H5O2+等微粒形式,H5O2+可看作是H3O+与H2O通过氢键形成的离子,则H5O2+的结构式是__。
(3)Zn的某种化合物M是很好的补锌剂,结构式如图:
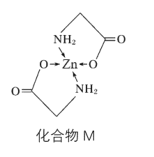
①1molM含有的σ键的数目为__。
②常见含N的配体有H2NCH2COO-、NH3、N3-等,NH3的分子空间构型为__,N3-的中心N原子杂化方式为__。
③M在人体内吸收率高的原因可能是锌形成螯合物后,电荷__(填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如表:
卤化锌/ZnX2 | ZnF2 | ZnCl2 | ZnBr2 | ZnI2 |
熔点/℃ | 872 | 283 | 394 | 445 |
则ZnX2熔点如表变化的原因是__。
(5)Zn的某种硫化物的晶胞如图所示。已知晶体密度为dgcm-3,且S2-、Zn2+相切,则Zn2+与S2+的核间距为__nm(写计算表达式)。
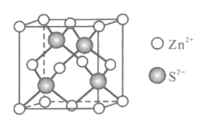
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的价电子排布式为______________________。
(2)A的最高价氧化物分子中,其中心原子采取________杂化;BC3-的立体构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)化合物CH3COO[Cu(NH3)3·CO]中与Cu+形成配离子的配体为____________(填化学式)。
(5) CH3COOH中C原子杂化轨道类型为_________________。
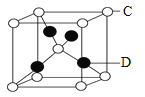
(6)元素D与元素C形成一种化合物其晶胞结构如图所示,该化合物的化学式为______.
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
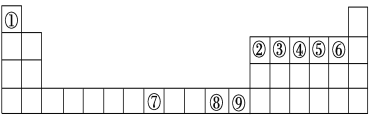
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的________区。
(2)④、⑥两元素形成的化合物的立体构型为________,其中心原子的杂化轨道类型为________。
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为___________。
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是____,写出与化合物A互为等电子体的一种阳离子______(填离子符号)。
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是______(填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型),化合物中⑦的化合价为:_______。根据等电子体理论,该化合物的配体的结构式为:_______,CaC2中,阴离子的电子式为: ____________________。
查看答案和解析>>
科目: 来源: 题型:
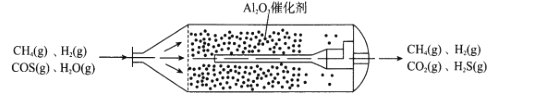
【题目】羰基硫(COS)主要存在于煤、石油和天然气中,会造成设备腐蚀、环境污染,更危害人体健康。目前,我国已经实现了在催化剂(γ-Al2O3)、低温条件下的精度脱除COS,如图为天然气中脱除COS反应流化床示意图:
(1)①已知:H2(g)+COS(g)![]() H2S(g)+CO(g) △H1=+6.2kJmol-1
H2S(g)+CO(g) △H1=+6.2kJmol-1
H2(g)+CO2(g)![]() H2O(g)+CO(g) △H2=+41.2kJmol-1
H2O(g)+CO(g) △H2=+41.2kJmol-1
则COS精度脱除反应H2O(g)+COS(g)![]() H2S(g)+CO2(g)的△H=__kJmol-1。
H2S(g)+CO2(g)的△H=__kJmol-1。
②将H2O与COS以体积比1:2置于恒温恒容密闭容器中反应,若测得该反应平衡时H2O与COS的体积比1:6,则该温度下,脱除反应的平衡常数K=__(保留两位小数)。
(2)T℃时,以一定流速、不同物质的量的H2O(g)和COS(g)通过流化床,测得COS(g)脱除速率变化关系如图。
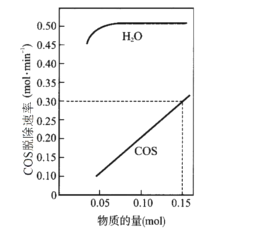
已知:COS脱除反应机理如下,其中吸附在催化剂表面的物种用*标注。
a.吸附:H2O→H2O*
b.反应:COS+H2O*→CO2+H2S*
c.脱附:H2S*→H2S
①若COS(g)脱除速率v=knx(COS)ny(H2O)(molmin-1),由图中的数据可算出x、k的值:x=__,k=__。
②“吸附”步骤为__(填“快反应”或“慢反应”),理由是__。
③脱除反应的决速步骤为__(填“a”、“b”或“c”)。
④少量氢气可以抑制催化剂积硫(S*)中毒,分析该流化床中可能存在的可逆反应是__。
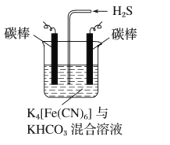
(3)工业上常采用下图所示电解装置,将气态废弃物中的硫化氢转化为可利用的硫。首先通电电解K4[Fe(CN)6]与KHCO3的混合溶液,通电一段时间后,再向所得溶液通入H2S时发生反应的离子方程式为2[Fe(CN)6]3-+2CO32-+H2S═2[Fe(CN)6]4-+2HCO3-+S↓.电解过程中阴极区电极反应式为_。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL0.1molL-1NH4HSO4溶液中逐滴加入0.1molL-1的NaOH溶液,溶液中由水电离出的c水(H+)与所加NaOH溶液的体积的关系如图所示。下列分析正确的是( )
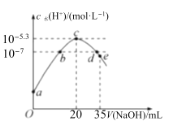
A.c点之前,主要的反应为NH4++OH-═NH3H2O
B.b点和d点对应溶液的pH均为7
C.常温下,Kb(NH3H2O)=5×10-5.4molL-1
D.d点溶液中,c(Na+)+c(NH4+)=c(SO42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】储量丰富成本低的新型电池系统引起了科学家的广泛关注。基于K+能够可逆地嵌入/脱嵌石墨电极,开发了基于钾离子电解液(KPF6)的新型双碳电池[碳微球(C)为正极材料,膨胀石墨(C*y)为负极材料],放电时总反应为:KxC*y+xC(PF6)=C*y+xK++xC+xPF6-,如图所示。下列叙述错误的是( )
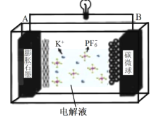
A.放电时,K+在电解质中由A极向B极迁移并嵌入碳微球中
B.充电时,A极的电极反应式为C*y+xK++xe-=KxC*y
C.放电时,每转移0.1NA电子时,电解质增重18.4g
D.充放电过程中,PF6-在碳微球电极上可逆地嵌入/脱嵌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com