
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了约翰·班尼斯特·古迪纳夫、迈克尔·斯坦利·惠廷汉姆和吉野彰,以表彰他们对锂离子电池研发的贡献。目前最安全的锂离子电池是LiFePO4电池,结构如图所示,电池中间是聚合物的隔膜,只允许Li+通过。
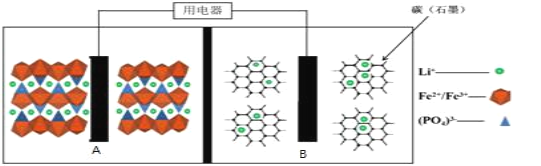
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A.放电时,B电极发生氧化反应
B.放电时,导线转移1mol电子,B电极室质量减少7xg
C.充电时,A极电极反应式:xLiFePO4-xe-=xFePO4+xLi+
D.充电时,Li+从A电极室向B电极室移动
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】从青蒿中提取青蒿素的方法之一是以萃取原理为基础的。乙醚浸取法的主要工艺如图所示:
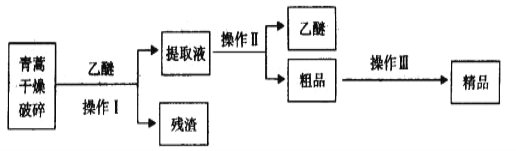
已知:青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。乙醚沸点为35℃。下列叙述错误的是( )
A.对青蒿干燥破碎后,加入乙醚的目的是溶解青蒿素
B.操作Ⅰ需要的玻璃仪器主要有烧杯、漏斗、玻璃棒
C.操作Ⅱ的名称是过滤
D.操作Ⅲ的主要过程可能是加95%的乙醇,浓缩、结晶、过滤
查看答案和解析>>
科目: 来源: 题型:
【题目】金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题。
(1)含碳量在0.03%2%之间某合金,是目前使用量最大的合金,这种合金是___。
A.铝合金 B.青铜 C.镁合金 D.钢
(2)FeCl3溶液用于腐蚀铜箔印刷线路板,反应的离子方程式为___。
(3)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是__(填字母),大量增加的离子有___(填化学式)。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(4)4Fe(NO3)2的高纯度结晶体是一种紫色潮解性固体,适合于制磁性氧化铁纳米粉末,工业上用废铁屑(含Fe和Fe2O3及其它不反应的物质)制取Fe(NO3)2晶体的方法如图:
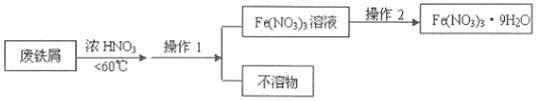
①第1步反应若温度过高,将导致硝酸分解,浓硝酸受热分解的化学方程式为___。
②磁性氧化铁的化学式为___,试写出Fe2O3与硝酸反应的离子方程式___。
③操作1的名称为___,操作2的步骤为:___、___,过滤洗涤。
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
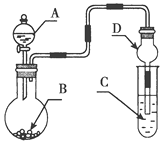
A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B.实验仪器D可以起到防止溶液倒吸的作用
C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
查看答案和解析>>
科目: 来源: 题型:
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)钠在空气中燃烧,得到的产物化学式为___,它的电子式为___。
(2)将一小块金属钠(2.3g)投入100mL水中,发生反应的离子方程式为__;可观察到的实验现象是__(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)向(2)所得溶液中加入5.4g铝单质充分反应,写出反应的化学方程式___,转移电子数目为___。
(4)Fe跟Cl2在一定条件下反应,所得产物的化学式是___。将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成__色。
b.向另一支试管中滴加NaOH溶液,现象为___,反应的离子方程式是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法正确的是( )
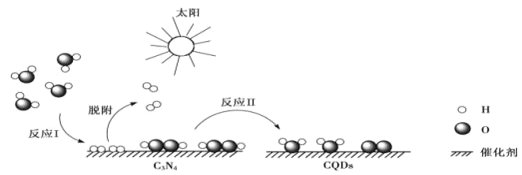
A.H2O2中存在非极性共价键,是非极性分子
B.反应Ⅰ中涉及到极性键的断裂和非极性键的形成
C.非极性分子中一定有非极性键,极性分子中一定有极性键
D.H2O由于存在分子间氢键而稳定性强
查看答案和解析>>
科目: 来源: 题型:
【题目】现有25℃时0.1molL-1的氨水,请回答以下问题:
(1)氨水呈碱性的原因为(用离子方程式表示)___。
(2)若向氨水中加入稀盐酸,使其恰好中和,写出反应的离子方程式___;若所得溶液的pH=5,则溶液中水所电离出的氢离子浓度为___。
(3)若向氨水中加入少量硫酸铵固体,此时溶液中![]() __(填“增大”、“减小”或“不变”)。
__(填“增大”、“减小”或“不变”)。
(4)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amolL-1,则c(SO42-)=__。
(5)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是___。
(6)二氧化硫通入0.1mol/L的氯化钡溶液中至饱和,无现象,若继续加入氨水,产生白色沉淀,用电离平衡解释原因___。
查看答案和解析>>
科目: 来源: 题型:
【题目】将物质的量相等的硫酸铝和硫酸铵溶于水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量.下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10 个电子。它们之间转化关系如下图所示。下列说法正确的是
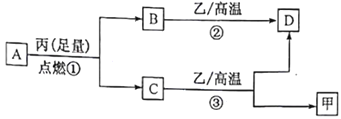
A. 原子半径:Z>Y>X
B. X与Y形成的化合物只含极性键
C. Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D. 气态氢化物的稳定性:A<C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com