
科目: 来源: 题型:
【题目】乙醇被称为21世纪的“绿色能源”。由于煤制乙酸工艺成熟、成本低廉,且乙酸相对乙醇有较大的价格差,因此开展乙酸加氢制乙醇的催化反应研究具有重要意义。回答下列问题:
(1)乙酸加氢制乙醇是一个复杂的反应体系,不同的反应条件会导致形成不同的产品分布,主要反应过程如下:
反应①CH3COOH(g) + H2(g)→CH3CHO(g) +H2O(g) H1
反应②CH3CHO(g) +H2(g) →CH3CH2OH(g) △H2
部分副反应如下:
反应③CH3CH2OH(g) + CH3COOH(g)→CH3COOCH2CH3(g) +H2O(g) H3
反应④CH3COOCH2CH3(g) +2H2(g) →2CH3CH2OH(g) H4
H4=___ (用H1、△H2、 H3表示)。
(2)乙酸加氢制乙醇的反应可表示为CH3COOH(g) + 2H2(g)==CH3CH2OH(g) + H2O(g) H<0,欲提高该反应中乙酸的平衡转化率,可采取的两条措施是_________。乙酸加氢生成乙酸乙酯( 副反应)的化学方程式可表示为____________.
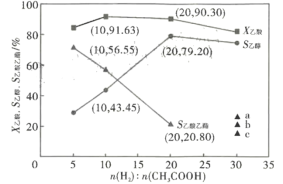
(3)在恒温2609°C, 恒压1.4MPa, 原料气以一定的流速通过某催化剂发生乙酸加氢制乙醇等反应,氢/酸(物质的量)投料比对反应的影响如图所示。X乙酸表示乙酸的转化率, S乙醇、S乙酸乙酯分别表示乙醇、乙酸乙酯的选择性,其中,S乙醇=![]() ,S乙酸乙酯=
,S乙酸乙酯=![]() 。根据图象及数据分析,最佳氢/酸投料比值是_______________,该条件下,上述反应②____________(填“能”或“不能”)进行到底,理由是____________ ;根据图中曲线变化规律,判断氢/酸投料比=30时,S乙酸乙酯曲线最可能延伸至图中a、b、c中的______点;氢/酸投料比=20时,计算H2的转化率=_______. ( 列出计算式即可,下同),乙醇的分压P乙醇=__________(分压=总压×物质的量分数)。
。根据图象及数据分析,最佳氢/酸投料比值是_______________,该条件下,上述反应②____________(填“能”或“不能”)进行到底,理由是____________ ;根据图中曲线变化规律,判断氢/酸投料比=30时,S乙酸乙酯曲线最可能延伸至图中a、b、c中的______点;氢/酸投料比=20时,计算H2的转化率=_______. ( 列出计算式即可,下同),乙醇的分压P乙醇=__________(分压=总压×物质的量分数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】锂离子电池历经半个世纪岁月的考验,作出重大贡献的三位科学家被授予2019 年诺贝尔化学奖。磷酸亚铁锂( LiFePO4)是新型锂离子电池的正极材料。某小组拟设计以一种锂辉石(主要成分为Li2O· Al2O3·4SiO2,含少量铁、钙、镁)为原料制备纯净的碳酸锂,进而制备LiFePO4的工艺流程:
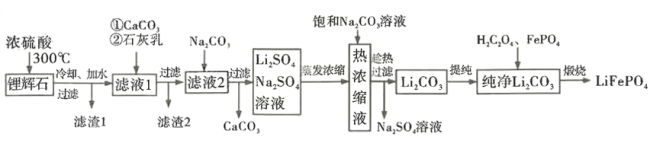
已知:LiO2·Al2O3·4SiO2+H2SO4(浓) ![]() Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
回答下列问题:
(1) LiFePO4含有锂、铁两种金属元素,它们焰色反应的颜色分别是_____________(填序号)。
A.紫红色、无焰色反应 B.黄色、无焰色反应
C.黄色、紫色 D.洋红色、黄绿色
(2)滤渣1的主要成分是_____________;向滤液1中加入适量的CaCO3细粉用于消耗硫酸并将Fe3+转化为红褐色沉淀,若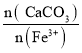 =3,反应的离子方程式为__________; 滤渣2的主要成分是Fe(OH)3、________、 CaSO4,其中 Fe(OH)3 脱水后可生成一种元素种类不变且摩尔质量为89 g·mol -1的新化合物,其化学式为_______________。
=3,反应的离子方程式为__________; 滤渣2的主要成分是Fe(OH)3、________、 CaSO4,其中 Fe(OH)3 脱水后可生成一种元素种类不变且摩尔质量为89 g·mol -1的新化合物,其化学式为_______________。
(3)已知碳酸锂在水中的溶解度随温度升高而减小,上述流程中趁热过滤的目的是________。
(4)煅烧制备LiFePO4时,反应的化学方程式为_____________________。
(5)某种以LiFePO4,作正极材料的锂电池总反应可表示为: LiFePO4+C![]() Li1-xFePO4 +CLix。放电时正极的电极反应式为__________。
Li1-xFePO4 +CLix。放电时正极的电极反应式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 C时,H2SO3的pKa1、pKa2(pK= -lgK)分别为1.89、7.20, NH3·H2O的pKb为4.72。常温时,下列指定溶液中粒子物质的量浓度关系正确的是
A.pH=3的H2SO3溶液中,c(HSO3 -) +2c(SO3-)=1 ×10-3 mol·L-1
B.0.1 mol·L-1H2SO3溶液用NaOH溶液滴定至pH =7.20, c( HSO3 ) =2c(SO3- )
C.0.1 mol.L-1H2SO3溶液用氨水滴定至pH=7.0, c(NH4+) =c(HSO3-) +c(SO32- )
D.0.1 mol·L-1NH4HSO3溶液中: c(NH4+ ) >c(H+) >c( NH3·H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】铅氧化还原液流电池是一种新型储能电池。该电池以酸性甲基磺酸铅溶液为电解液,简化的工作原理如图所示,下列说法正确的是
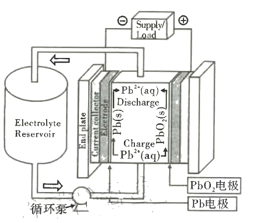
A.放电时,H+经过循环泵向Pb电极移动
B.放电时,负极反应式为Pb-2e- +SO42- = PbSO4
C.充电时,电解液中H+、Pb2+的物质的量浓度均减小
D.充电时,阳极反应式为Pb2+ +2H2O-2e- = PbO2 +4H+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式不能用来解释相应实验现象的是
选项 | 实验现象 | 离子方程式 |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | Mg(OH)2+2NH4+ |
B | 向酸性KMnO4溶液中滴加草酸钠溶液,紫色溶液褪色 | 2MnO4-+5C2O42-+8H2O=2Mn2++10CO2↑+16OH- |
C | 将二氧化硫通入足量的Ba(NO3)2溶液中,产生白色沉淀和无色气体(遇空气变红棕色) | 3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+ |
D | 氢氧化铁溶于HI溶液中 | 2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关有机化合物的说法错误的是
A.葡萄糖和淀粉互为同系物
B.植物油含不饱和脂肪酸甘油酯,与氢气加成后生成固态的人造脂肪
C.对三联苯(![]() )分子中在同一直线上的原子最多有8个
)分子中在同一直线上的原子最多有8个
D.分子式为C7H16的烷烃,最长碳链上有5个碳原子的同分异构体共有5种(不含立体异构)
查看答案和解析>>
科目: 来源: 题型:
【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质结构 信息 | 核外电子共有7种运动状态 | 原子的M层有1对成对的p电子 | 一种核素的中子数为35、质量数为64 | 有多种同位素,其中一种用做测量相对原子质量的校准 |
(1)写出B原子的电子排布式___________。写出C原子的电子排布式___________
(2)四种元素中非金属性最强的元素是____,金属性最强的元素是_____,第一电离能最大的元素是______;
(3)一定条件下B、C单质间能反应,相应的反应方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙在工农业生产中有广泛的用途。
Ⅰ.过氧化钙制备方法很多。
(1)制备方法一:H2O2溶液与过量的Ca(OH)2悬浊液反应可制备CaO2·8H2O,其化学方程式为______________________________________________________________。
(2)制备方法二:利用反应Ca(s)+O2![]() CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
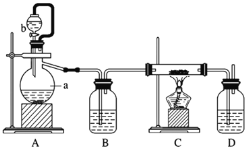
请回答下列问题:
①装置A中反应的化学方程式为________________,仪器a的名称为 ___________。
②装置D中盛有的液体是浓硫酸,其作用一是_________;二是_____________。
Ⅱ.水产运输中常向水中加一定量CaO2·8H2O增加溶氧量(DO),水中溶氧量(DO)是用每升水中溶解氧气的质量来表示,其测定步骤及原理为:
a.固氧:碱性下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+4OH=2MnO(OH)2↓;
b.氧化:酸性下,MnO(OH)2将I氧化为I2:MnO(OH)2+2I+4H+=Mn2++I2+3H2O;
c.滴定:用Na2S2O3标准溶液滴定生成的I2:2S2O32-+I2=S4O62-+2I。
某同学向水中加一定量CaO2·8H2O,取此水样100.00mL,按上述方法测定水中溶氧量(DO),消耗0.0100mol·L1 Na2S2O3标准溶液13.50mL。
(1)滴定过程中使用的指示剂是_______________________________;
(2)该水样中的溶解氧量(DO)为__________________mg·L1。
(3)步骤b中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因________________________(用离子方程式表示,至少写出2个)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜离子是人体内多种酶的辅因子,某化合物与Cu+结合形成如图所示的离子。下列有关该离子说法正确的是( )
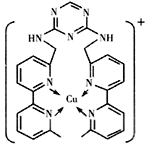
A. 该离子中碳原子的杂化方式为sp2
B. 该离子中氮原子的杂化方式为sp2
C. 该离子中只有共价键(含配位键),没有离子键
D. H、N、Cu三种元素的电负性顺序为:Cu>H>N
查看答案和解析>>
科目: 来源: 题型:
【题目】固体A的化学式为NH5(也可写为:NH4H),它的所有原子的最外层均满足2个或8个电子的稳定结构。则下列有关说法中错误的是( )
A.它与水反应的化学方程式为NH5 + H2O ═ NH3H2O + H2↑
B.NH5中既有共价键又有离子键
C.NH5的电子式为 
D.1 mol NH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com