
科目: 来源: 题型:
【题目】完成下列计算(注意单位)
(1)在标准状况下,1.7 g氨气所占的体积约为_________L,它与同条件下_____mol H2S含有相同的氢原子数。
(2)在标准状况下,0.5 mol任何气体的体积都约为________ L。
(3)4 g H2与22.4 L(标准状况)CO2相比,所含分子数目较多的是________。
(4)0.01 mol某气体的质量为0.28 g,该气体的摩尔质量为________。
(5)0.3 mol NH3分子中所含氢原子数与____________个H2O分子中所含氢原子数相等。
(6)含0.4 mol Al3+的Al2(SO4)3中所含的SO![]() 的物质的量是________mol。
的物质的量是________mol。
(7)2.3 g Na中含电子的物质的量为___________mol,在跟足量水反应中失去电子的物质的量为____________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.3 mol·L-1 NaOH溶液480 mL和一定浓度的盐酸溶液。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是_____________(填序号)。
(2)在配制NaOH溶液时:
填写下列表格:
应称取NaOH的质量/g | 应选用容量瓶的规格/mL |
__________________ | __________________ |
(3)容量瓶上需标有以下五项中的_________________(填序号)。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)下列配制的溶液浓度偏低的是________________________(填序号)。
A.配制前,容量瓶中有少量蒸馏水
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
C.加蒸馏水时不慎超过了刻度线
D.定容时俯视刻度线
(5)下图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/mL
HCl的质量分数:36.5%
①该浓盐酸中HCl的物质的量浓度为_________molL-1。
②取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是____________
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有_________影响?(在横线上填“偏大”、“偏小”、“无影响”)。
Ⅰ溶液注入容量瓶前没有冷却至室温________
Ⅱ 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水_________
查看答案和解析>>
科目: 来源: 题型:
【题目】青蒿素是我国药学家屠呦呦在1971年发现的一种含有过氧基团的倍半萜内酯的无色针状晶体,不溶于水,易溶于乙醇、石油醚、苯等有机溶剂,熔点为156℃,沸点389.9℃,热稳定性差。一种超声提取青蒿素的主要工艺流程如图:
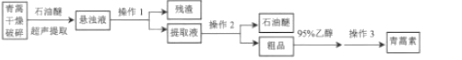
已知:石油醚的沸点为30~80℃;青蒿素在95%乙醇中的溶解度随温度的升高而增大。
(1)超声提取的原理是在强大的超声波作用下,使青蒿细胞乳化、击碎、扩散,其优点有______等(答一点即可)。
(2)操作1的名称是______。
操作2应选的合理装置是______(填标号),青蒿素粗品在______(仪器名称)中。
操作3的步骤是蒸发浓缩、______、过滤、洗涤、干燥。
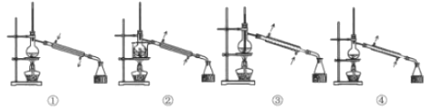
(3)操作3中若温度过高,会降低青蒿素的产率,其原因可能是______。
(4)青蒿素只含C、H、O三种元素。某学生采用如图装置(加热及夹持装置省略)测定其最简式CxHyOz。
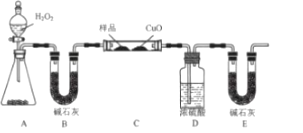
①该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是______。
②取2.82g青蒿素样品,用改进后的装置进行实验。实验后测得装置D增重1.98g,装置E增重6.60g,则x:y:z=______(填最简整数比),要确定青蒿素的分子式,还需测量的数据是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】判断正误,正确的画“√”,错误的画“×”
(1)2 g D![]() O中含有的质子数、中子数均为NA_______
O中含有的质子数、中子数均为NA_______
(2)过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA_______
(3)1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA_______
(4)标准状况下,5.6 L NO和5.6 L O2组成的混合气体中所含原子数为NA_______
(5)0.1 mol钠和O2在一定条件下反应完全生成Na2O和Na2O2混合物时,失去电子数为0.1NA _______
(6)14 g乙烯和丙烯混合气体中的氢原子数为2NA_______
(7)在1L 0.1mol·L﹣1碳酸钠溶液中,阴离子总数大于0.1NA _______
(8)高温下,16.8 g Fe与足量水蒸气完全反应失去电子数为0.8 NA _______
(9)标准状况下,氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为4NA_______
(10)常温常压下 ,1 L液态水中含有的H+数目为10-7NA_______
(11)一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3 NA _______
(12)标准状况下,2.24 L CCl4含有的共价键数为0.4NA_______
(13)标况下,22.4L己烷的分子个数为NA_______
(14)含1 mol H2SO4的浓硫酸与足量Zn反应转移的电子总数为2NA_______
(15)在1L 0.1mol·L﹣1氯化铵溶液中,NH4+ 和NH3·H2O的个数之和为NA _______
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCoO2、 LiFePO4常用作锂离子电池的正极材料。
基态Co原子核外电子排布式为___________________,第四电离能I4(Co) _________I4(Fe)(填“>”或“<”),PO43-的空间构型为___________________。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。在CO分子中,σ键与π键数目之比为_________。
(3)铁与K2O、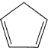 (环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,配体配位数为 ________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________晶体。
(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,配体配位数为 ________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________晶体。
(4)与铁同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种,往其溶液中加BaCl2溶液时,有白色沉淀;加入AgNO3溶液时,没有沉淀生成;加入氢氧化钠溶液时,无气体生成。则此种配合物的化学式为 _________________________。
(5)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
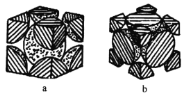
在图a所示堆积方式里铁原子的堆积方式为___________________________。
在图b所示堆积方式里铁原子的总体积占晶体体积的比例为(空间利用率)_________。
查看答案和解析>>
科目: 来源: 题型:
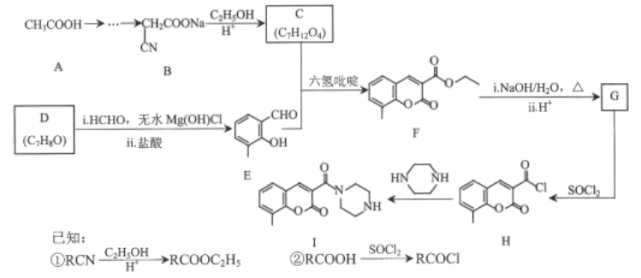
【题目】香豆素及其衍生物在医药、农药、染科等领域有广泛用途。某香豆素衍生物Ⅰ具有抗病毒、抗癌的动多种生物活性,其合成路线如图所示:
 回答下列问题:
回答下列问题:
(1)D的名称是______。F中的含氧官能团的名称是______。
(2)H→I的反应类型为______。
(3)C分子具有对称结构,该化合物的结构简式为______。
(4)F→G中i的化学方程式为______。
(5)E的同分异构体中,满足下列条件的有______种;
①含有苯环
②能发生水解反应
其中核磁共振氢谱有4组峰且峰面积之比为3:2:2:1的结构简式为______(写出一种即可)。
(6)根据上述路线,设计以苯酚、乙醇、丙二酸、甲醛为原料制备![]() 的合成路线______(其他无机试剂自选)。
的合成路线______(其他无机试剂自选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,pH=12的氢氧化钠溶液中含有OH- 数目为0.01 NA
B.22.4 L(标准状况)氩气含有的质子数为18NA
C.92.0 g甘油(丙三醇)中含有羟基数为1.0NA
D.含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
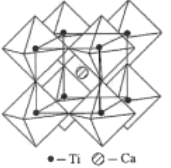
【题目】钛被称为继铁、铝之后的第三金属,其常见的化合物有钙钛矿、硫酸氧钛(TiOSO4)、钛酸(H2TiO3)、二氧化钛(TiO2)、四氯化钛(TiCl4)等,回答下列问题:
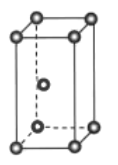
(1)基态钛原子的价层电子排布式为______,金属钛晶体的晶胞结构如图所示,其堆积方式名称为______。
(2)硫酸氧钛的阳离子为TiO2+,其阴离子的VSEPR模型名称为______。TiOSO4在水溶液中不稳定,易生成钛酸沉淀,该反应化学方程式为______。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图:
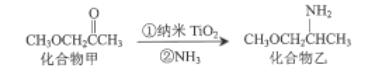
化合物乙种C、N、O元素的第一电离能由大到小的顺序为______。化合物甲的沸点低于化合物乙的沸点,主要原因是______。
(4)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,由此可知TiCl4为______晶体。将TiCl4加入盐酸中,经处理可得到一种配位数为6的绿色晶体TiCl36H2O,1mol该晶体恰好与含2molAgNO3的溶液反应得到白色沉淀,则该绿色晶体中配离子的化学式为______。
(5)钙钛矿的一种晶体结构如图所示。Ti位于立方晶胞的顶点,每个Ti被6个O包围成配位八面体,Ca位于立方晶胞的体心,与Ca距离最近的O有______个;若Ca与Ti的最近核间距为apm,阿伏伽德罗常数为NA,则此钙钛矿的密度为______gcm-3.(列出计算式即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数用NA表示,下列叙述中正确的个数是( )
①标准状况下,22.4L乙醇中含有的氧原子数目为NA
②6.4g的34S2和34S8混合物中,含硫原子总数为0.2NA
③12g金刚石含有的共价键数为2NA
④1L含NA个NH3·H2O的氨水,其浓度为1mol·L-1
⑤含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子
⑥11.2L Cl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
A.②④B.③⑤C.④⑥D.①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com