
科目: 来源: 题型:
【题目】在给定条件下,下列选项所示的物质问转化均能实现的是
A.SiO2(s)![]() H2SiO3(S)
H2SiO3(S)![]() Na2SiO3(aq)
Na2SiO3(aq)
B.Cu2S(s)![]() Cu(s)
Cu(s)![]() CuCl2(s)
CuCl2(s)
C.Fe(s)![]() Fe2O3(s)
Fe2O3(s) ![]() Fe2(SO4)3
Fe2(SO4)3
D.NaCl(aq) ![]() Na2CO3(s)
Na2CO3(s) ![]() NaOH(aq)
NaOH(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,其中A、C、D、E为短周期元素,最外层电子数之和为23,下列说法正确的是

A.元素A的氢化物,在同族元素中沸点最低
B.元素B的金属性比E弱
C.A、C、D均可形成18e-分子
D.与金属钠的反应中,1mol C原子和1 mol E原子得电子数目一定相等
查看答案和解析>>
科目: 来源: 题型:
【题目】半导体光催化CO2机理如图甲所示,设计成电化学装置如图乙所示,则下列说法正确的是
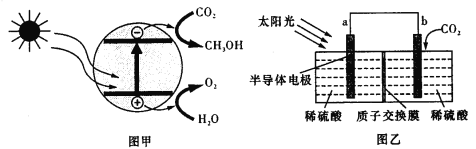
A.若导线上有4mol电子移动,则质子交换膜左侧产生22.4LO2
B.装置中进行的总反应一定是自发的氧化还原反应
C.图乙中的能量转化形式为:光能→电能→化学能
D.b极上的电极反应为:CO2+6H+-6e-![]() CH3OH+H2O
CH3OH+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】德国化学家哈伯在合成氨方面的研究促进了人类的发展。合成氨的工业流程如图,下列说法错误的是

A.增大压强既可以加快反应速率,又可以提高原料转化率
B.升高温度可提高平衡转化率
C.冷却过程中采用热交换有助于节约能源
D.原料循环可提高其利用率
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.常温常压下,18g甲烷(14CH4)所含的中子数为9NA
B.25℃时,pH=7的纯水中含OH-的数目为10-7NA
C.铜与浓硝酸反应生成NO2、N2O4共23g,则铜失去的电子数为0.5NA
D.密闭容器中2mol NO与1mol O2充分反应,所得产物的分子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】废旧钴金属片中的钴有+2价和+3价,还含有锰、铁、钙、镁、铝等金属元素及碳粉等,回收钴的工艺流程如下:
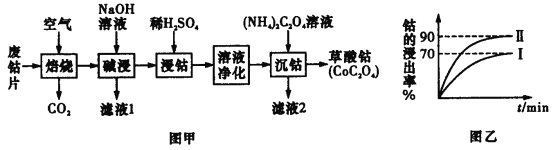
(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是____________________(任写一条)。
(2)该流程中浸钴时,钴的浸出率最高只能达到70%,后来改进方法,加入使用硫酸进行第一次浸取后,再加入Na2SO3溶液进行第二次浸取,从而使钴的浸出率达90%以上,写出第二次浸出钴时溶液中发生反应的离子方程式:____________________。
(3)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液pH为1.5~2.0后,加H2O2,反应一段时间,加8%Na2CO3溶液,将溶液的pH调至4.0~5.0。已知Fe(OH)3的溶度积常数为4×10-38,则当溶液的pH调至4.0时,溶液中的c(Fe3+)=__________mol·L-1。
②除锰:加入NaClO溶液。写出该离子方程式:____________________。
③减钙镁:加入NH4F溶液,沉淀大部分的钙、镁的离子。

试解释为何草酸铵溶液沉钴前要减钙镁:______________________________。
(4)滤液2的主要成分为____________________(以化学式表示)。
(5)得到的草酸钴沉淀须洗涤干燥。写出检验沉淀已被洗净的操作与现象__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组进行如图实验。欲使溶液红色加深,下列操作或分析正确的是

A.加入少量KCl固体
B.再滴加5~6滴1 mol/L KSCN溶液
C.再滴加3~5滴0.01 mol/L NaOH溶液
D.对溶液降温,也可观察到溶液红色加深,说明反应为:FeCl3+3KSCN![]() Fe(SCN)3+3KCl△H>0
Fe(SCN)3+3KCl△H>0
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组设计如图实验,欲使甲中试管先出现浑浊,下列操作一定达不到目的的是

A.向甲烧杯中加入适量CaOB.向甲中试管内滴加适量浓硫酸
C.向乙烧杯中加入适量冰块D.增大甲装置所在环境的压强
查看答案和解析>>
科目: 来源: 题型:
【题目】花椒毒素(H)有抗实验性心律失常、镇痛、抗炎等作用。由芳香族化合物A为原料合成H的一种合成路线如下:
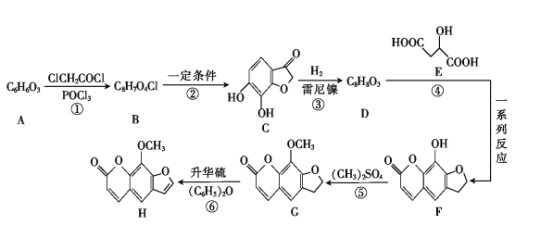
已知:![]() +ClCH2CH2Cl
+ClCH2CH2Cl![]()
![]() +HCl
+HCl
回答下列问题:
(1)A的化学名称是 _____(用系统命名法)。
(2)G中所含官能团的名称是 ____。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。E中___ (填“有”或“没有”)手性碳。
(4)反应⑥的反应类型是 ____ 。
(5)D的结构简式为 _____。
(6)F与足量NaOH溶液反应的化学方程式为 ____。
(7)芳香族化合物W是D的同分异构体,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应;W的核磁共振氢谱有5组峰,且面积比为1∶2∶2∶2∶1。符合上述要求的W有____种。
(8)有机物M(![]() )是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
)是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
查看答案和解析>>
科目: 来源: 题型:
【题目】(NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(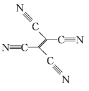 )。
)。
①CH3CN中碳原子的杂化方式是 ____ 和_____ 。
②TCNE中第一电离能较大的是 ___(填元素符号),分子中所有原子____(填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:
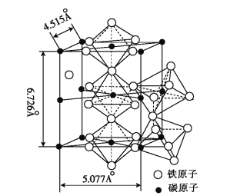
Fe3C的密度为 ___(列出计算式)g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com