
科目: 来源: 题型:
【题目】近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好。如图是以煤为原料生产聚氯乙烯(PVC)和人造羊毛的合成路线。
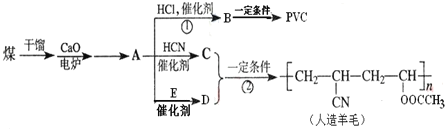
请回答下列问题:
(1)写出反应类型:反应①___;反应②___。
(2)写出结构简式:PVC___;E___。
(3)按要求写出化学方程式:
①→A:___;
②检验E中含氧官能团:___;
③Y+Z生成乙酸乙酯:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】阿巴卡韦(Abacavir) 是一种核苷类逆转录酶抑制剂,存在抗病毒功效。关于其合成中间体M(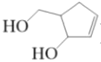 ),下列说法正确的是
),下列说法正确的是
A.与环戊醇互为同系物B.分子中所有碳原子共平面
C.和1 mol 钠反应可以生成 22.4 L 氢气D.可用碳酸氢钠溶液鉴别乙酸和M
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将0.20 mol/LKMnO4酸性溶液 0.l0L与一定量pH=3.0的草酸(HOOC-COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是
A.9 g HOOC-COOH含共用电子对数目为0.9NA
B.当0.01mol KMnO4 被还原时,强酸提供的H+数目为 0.01NA
C.pH=3.0的草酸溶液含有H+数目为0.001NA
D.该反应释放 CO2分子数目为VNA/22.4
查看答案和解析>>
科目: 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量 FeS和 SiO2)中回收铍和铜两种金属的工艺流程如图:
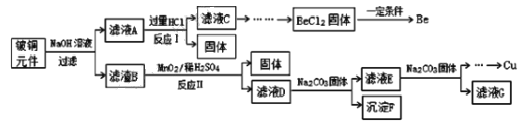
已知:
Ⅰ.铍、铝元素化学性质相似;
Ⅱ.常温下部分难溶物的溶度积常数如表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
Ksp | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的成分除 NaOH、Na2BeO2外,还有________(填化学式),写出反应I中Na2BeO2,与过量盐酸反应的化学方程式:_________________。
(2)从滤液C 中提纯纯BeCl2,最合理的实验步骤顺序为_________(填字母)
a.加入过量的氨水 b.通入过量 CO2 c.加入过量NaOH溶液 d.加入适量HCl e.洗涤 f.过滤
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的离子方程式:__________。若用浓HNO3溶解金属硫化物,缺点是________(任写一条)
(4)滤液D中c(Cu2+)= 2.2 molL-1、c(Fe3+) = 8.0×10 -3molL-1、c(Mn2+)= 0.01molL-1,逐滴加入 Na2CO3溶液调节pH 可将其转变成氢氧化物依次分离,首先沉淀的是______ (填离子符号)。为使铜离子开始沉淀,常温下应调节溶液的pH____4。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种环状高分子P3的合成路线如图:
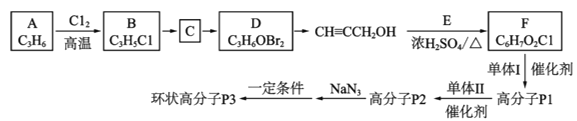
已知:①P2的结构为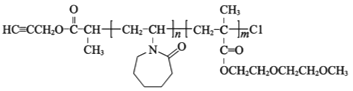
②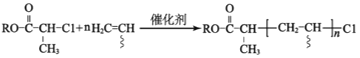 (
(![]() 表示取代基)
表示取代基)
③RCl![]() RN3
RN3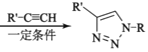
(1)A是一种常用的化工原料,其中包括的官能团是__。
(2)B→C的反应类型是__。
(3)D生成CH![]() CCH2OH的反应条件是__。
CCH2OH的反应条件是__。
(4)上述流程中生成F的反应为酯化反应,则该反应的化学方程式是__。
(5)单体II的结构简式是__。
(6)下列说法正确的是__(填字母)
a.F→P1的反应类型为缩聚反应
b.P3的结构如图所示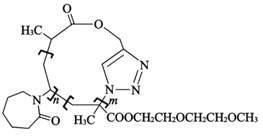
c.P2→P3的过程中可能得到线型高分子
d.碱性条件下,P3可能彻底水解成小分子物质
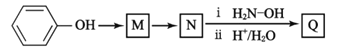
(7)已知: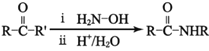 ;Q(C6H11NO)是用于合成单体I的中间体。如图是以苯酚为原料合成Q的流程,M→N的化学方程式是__。
;Q(C6H11NO)是用于合成单体I的中间体。如图是以苯酚为原料合成Q的流程,M→N的化学方程式是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示。已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;②有关有机物物的沸点如下表:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
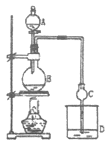
A中放醋酸,B中将过量的乙醇与少量浓硫酸混合,D中放有饱和碳酸钠溶液,经分液漏斗边滴加醋酸、边加热。
请回答:
(1)反应混合物的配制:圆底烧烧瓶中先加入___,再逐滴加入___,边加边振荡,___后,再加入醋酸。
(2)反应中加入的乙醇是过量的,其目的是___;浓硫酸的作用:①___;②___。
(3)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为___。
(4)加热除了加快反应速率外还有一个重要的目的:___。
(5)在装置中,球形干燥管主要起到两个作用:一是起冷凝作用,二是:___。
(6)试管中盛放的是饱和碳酸钠溶液,它的作用是___(选填编号)。
A.中和乙酸和乙醇 B.吸收乙酸并溶解乙醇
C.降低乙酸乙酯的溶解度,有利于析出 D.加速乙酸乙酯的生成,提高其产率
(7)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出___;再加入___(此空从下列选项中选择),目的是___,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.碱石灰 B.无水硫酸钠 C.生石灰
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,三硫代碳酸钠(Na2CS3)是玫瑰红色针状固体,与碳酸钠性质相近。在工农业生产中有广泛的用途。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验一:探究Na2CS3的性质
(1)向Na2CS3溶液中滴入酚酞试液,溶液变红色。用离子方程式说明溶液呈碱性的原因__。
(2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。该反应中被氧化的元素是__。
实验二:测定Na2CS3溶液的浓度
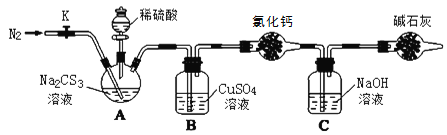
按如图所示连接好装置,取50.0mLNa2CS3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol·L-1稀H2SO4,关闭活塞。
已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,密度1.26g·mL-1,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放碱石灰的仪器的名称是__,碱石灰的主要成分是__(填化学式)。
(4)反应结束后打开活塞K,再缓慢通入热N2一段时间,其目的是_。
(5)C中发生反应的离子方程式是__。
(6)为了计算Na2CS3溶液的浓度,对充分反应后B中混合物进行过滤、洗涤、干燥、称重,得8.4g固体,则三颈瓶中Na2CS3的物质的量浓度为__。
(7)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氟及其化合物用途十分广泛,回答下列问题:
(1)氟化物OF2、NF3、SiF4、PF5、SF6中,中心原子采取sp3杂化的是__。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸。锑的价电子排布式为__。阳离子[H2F]+的空间构型为__,写出[H2F]+的等电子体__(分子和离子各举一例)。
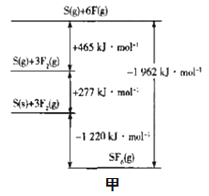
(3)SF6被广泛用于高压电器设备的绝缘介质。根据__理论,可判断出其空间构型为正八面体。SF6的键能可通过类似Born-Haber循环能量构建能量图(图甲)计算键能,则S-F的键能为___kJmol-1。
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3[AlF6]降低Al2O3的熔点。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na3[AlF6]+3CO2↑+9H2O。
①测定气态HF的摩尔质量时,往往得不到20gmol-1的数据,原因是__。
②冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在__(填序号)。
a.离子键 b.极性键 c.配位键 d.范德华力
③反应物中元素(氢除外)的第一电离能从大到小的顺序为__(用元素符号表示)。
④工业上不用电解熔点更低的AlCl3制取铝的原因为__。
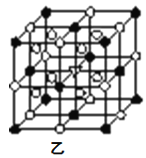
⑤冰晶石由两种微粒构成,冰晶石的晶胞结构如图乙所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__(填具体的微粒符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空
名称 | 结构简式 | ||
(1) | ___ | (6)最简单的有机物 | ___ |
(2) | ___ | (7)对氢气的相对密度为46的某芳香烃 | ___ |
(3) | ___ | (8)甘油 | ___ |
(4) | ___ | (9)最重要的化工石油水平衡量标准 | ___ |
(5)HCHO | ___ | (10)碳原子数在3-6的烷烃中其一氯代物只有一种 | ___ |
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.2mol两种气态烃组成的混合气体,完全燃烧后得到6.72L二氧化碳(标准状况下)和7.2g水,下列说法正确的是( )
A.一定有乙烯烯B.一定有甲烷
C.一定没有甲烷D.一定没有乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com