
科目: 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
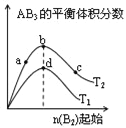
A. 图中T2一定大于T1
B. 图中b点速率一定大于d点速率
C. 达到平衡时,A2的转化率大小为:c>b>a
D. 加入催化剂可以使状态d变为状态b
查看答案和解析>>
科目: 来源: 题型:
【题目】将反应![]() 设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )

A.![]() 盐桥中的
盐桥中的![]() 移向
移向![]() 溶液
溶液
B.![]() 作负极,发生还原反应
作负极,发生还原反应
C.若将盐桥换成银丝,工作一段时间后,![]() 溶液中
溶液中![]() 减小
减小
D.若将盐桥换成银丝,当锌电极质量减少![]() ,银电极质量增加
,银电极质量增加![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g) △H = +185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.化学反应的限度不可以通过改变条件而改变
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 和
和![]() 充入体积不变的密闭容器中,在一定条件下发生下列反应:
充入体积不变的密闭容器中,在一定条件下发生下列反应:![]() ,到达平衡时,
,到达平衡时,![]() 为
为![]() ,如果此时移走
,如果此时移走![]()
![]() 和
和![]() ,在相同温度下再达平衡时
,在相同温度下再达平衡时![]() 的物质的量是( )
的物质的量是( )
A.![]() B.
B.![]() C.大于
C.大于![]() ,小于
,小于![]() D.小于
D.小于![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A. | 向 | 黄色逐渐消失,加 | 还原性: |
B. | 将金属钠在燃烧匙中点燃,迅速伸入集满 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
|
C. | 将足量的 | 酸性 |
|
D. | 将 | 先有白色沉淀生成,后变为蓝色沉淀 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】双安妥明[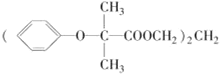 ]可用于降低血液中的胆固醇,该物质合成线路如图所示:
]可用于降低血液中的胆固醇,该物质合成线路如图所示:
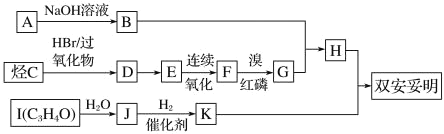
已知:Ⅰ.RCH2COOH![]()
![]()
![]()
![]() 。
。
Ⅱ.RCH=CH2![]() RCH2CH2Br。
RCH2CH2Br。
Ⅲ.C 的密度是同温同压下 H2 密度的 28 倍,且支链有一个甲基,I能发生银镜反应且 1 molI(C3H4O)能与 2 mol H2 发生加成反应;K 的结构具有对称性。试回答:
(1)A的结构简式为__________。
(2)反应 D→E 的化学方程式为________; 反应类型是_______。
(3)C 的名称为______。
(4)与 F 互为同分异构体,且属于酯的有机物有_____种。其中核磁共振氢谱有 3 组峰,峰面积之比为 6∶1∶1 的结构简式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点 232 ℃)与 Cl2反应制备 SnCl4,装置如图。
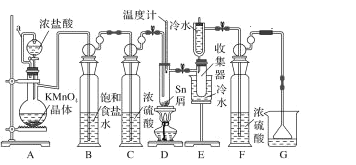
已知:①SnCl2、SnCl4 有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4 极易水解生成 SnO2·xH2O。回答下列问题:
(1)导管 a 的作用是_____,装置 A 中发生反应的离子方程式为_____。
(2)当观察到装置 F 液面上方_____时才开始点燃 D 处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是①_________;②_____。
(3)若上述装置中缺少装置 C( 其它均相同) ,则D处具支试管中发生的主要副反应化学方程式为_____。
(4)Cl2和锡的反应产物有 SnCl4 和 SnCl2,为防止产品中带入过多的 SnCl2,可使用的温度范围是_____。
(5)滴定分析产品中 Sn(Ⅱ)的含量:用分析天平称取 5.000g 产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用 0.1000 mol·L-1 的碘标准溶液滴定至终点时消耗 20.00 mL,则产品中 Sn(Ⅱ)的含量为_____。(已知 Sn2++I2=2I-+Sn4+)
查看答案和解析>>
科目: 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数,下列叙述中正确的是( )
表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,![]() 二氧化硫含有的原子数等于
二氧化硫含有的原子数等于![]()
B.标准状况下,![]() 中所含分子数为
中所含分子数为![]()
C.常温常压下,![]() 水所含电子数为
水所含电子数为![]()
D.常温常压下,![]() 与
与![]() 混合物含有的硫原子数为
混合物含有的硫原子数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】铝及其化合物广泛应用于金属冶炼、有机合成等领域。
(1)铝热反应可以冶炼金属铬,Cr3+基态核外电子排布式为__________。
(2)AlCl3可做反应 的催化剂。
的催化剂。
①乙酸酐分子中发生sp3杂化的原子有_____个。
②1mol对甲基苯乙酮分子中含有σ键的数目为______mol。
③CH3COOH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为________。
④单个AlCl3气态分子的空间构型为_____,AlCl3可与Cl-形成AlCl4-,与AlCl4-互为等电子体的分子为_______。
(3)某遮光剂的晶胞如图所示,由晶胞可知。n=_______。

查看答案和解析>>
科目: 来源: 题型:
【题目】目前,处理烟气中 SO2 常采用两种方法:碱液吸收法和水煤气还原法。
Ⅰ.碱液吸收法
25℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收 SO2,并在空气中氧化;
第2步:加入石灰水,发生反应 Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3·H2O K。
(1)25℃时,0.1 mol·L-1(NH4)2SO3 溶液的 pH_____(填“>”“<”或“=”)7。
(2)计算第2步中反应的 K=_____。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g)=S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO 的燃烧热ΔH3=-283 kJ·mol-1
(3)表示液态硫(S)的燃烧热的热化学方程式为_________。
(4)反应②中,正反应活化能 E1_____(填“>”“<”或“=”)ΔH2。
(5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[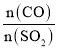 =y]、温度 T 的关系如图所示。
=y]、温度 T 的关系如图所示。
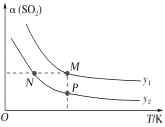
比较平衡时CO的转化率α(CO):N_____M。逆反应速率:N_____P(填“>”“<”或“=”)。
(6)某温度下,向10L恒容密闭容器中充入2molH2、2 molCO和2molSO2发生反应①、②,第5min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应②的平衡常数K为_____。
②其他条件不变,在第 7 min 时缩小容器体积,SO2的平衡浓度_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com