
科目: 来源: 题型:
【题目】三氧化二锰(Mn2O3)可用作纺织行业的印染剂。为充分利用资源,探究废旧干电池的变废为宝,在实验室中用废旧干电池中的MnO2制备Mn2O3,流程如图:
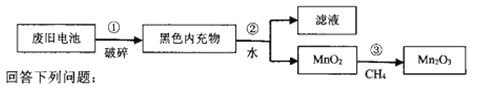
(l)步骤②加水后的操作,需要的玻璃仪器除烧杯外还需__(填标号)。
A.玻璃棒 B.分液漏斗 C.普通漏斗 D.酒精灯
(2)步骤③用图中的甲装置所产生的CH4,还原MnO2制备Mn2O3。
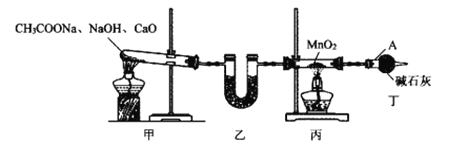
①仪器A的名称为__,装置乙内盛有的试剂可以是__(填标号)。
a.浓硫酸 b.碱石灰 c.胆矾 d.五氧化二磷
②实验过程中先点燃__(填“甲”或“丙”)处的酒精灯,点燃丙处酒精灯前需进行的操作是___。
③测定装置丙内生成物中CO、CO2物质的量为1:1,则该反应的化学方程式为__。
④该装置存在的缺陷为__。
(3)实验结束,仪器冷却后,称取装置丙内粗产品为7.19g,使之与足量硫酸酸化的KI溶液反应(粗产品中的Mn2O3和MnO2的锰元素均转化为Mn2+),将该混合液稀释至500mL,然后取25.00mL稀释后的溶液,用0.200molL-1的Na2S2O3;标准溶液滴定,达到滴定终点时,消耗Na2S2O3标准溶液为25.00mL。(已知:I2+2Na2S2O3═Na2S4O6+2NaI)
①该滴定过程中可以选用__作指示剂。
②若滴定前滴定管内无气泡,达到滴定终点时,尖嘴处有气泡,则测定的标准液的体积__(填“偏大”、“偏小”或“无影响”)。
③粗产品中Mn2O3的纯度为__%。(保留小数点后1位)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业排放的烟气中的SO2是大气的一次污染物之一,同时也是雾篮天气的重要前体物。工业上常用氨水吸二氧化硫气体。常温时,向10mL0.1molL-l的氨水中通入SO2,SO2体积(标准状况)与溶液pH的关系如图所示(忽略溶液体积变化)。
已知:25℃时,NH3H2O的Kb=l.7×l0-5,H2SO3的Ka1=l.3×10-2,Ka2=6.2×l0-8。
回答下列问题:
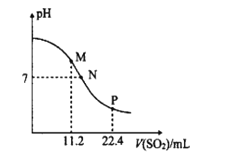
(1)M点溶液中阴离子浓度由大到小的顺序为__,![]() __(填>、=或<)2。
__(填>、=或<)2。
(2)N点溶液中的溶质为__(填化学式),c(NH4+):c(HSO3-)=__。
(3)水的电离程度M点__P点(填“大于”、“小于”或“等于”)。
(4)反应NH3H2O+H2SO3![]() NH4++HSO3-+H2O的平衡常数K=__。
NH4++HSO3-+H2O的平衡常数K=__。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物 A 是一种重要的化工原料,以 A为起始原料可合成药物 I(结构简式如下),其合成路线如下:

已知:①有机物 D 为芳香烃
②RNH2+
![]()
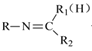 +H2O
+H2O
回答下列问题:
(1)F 的名称是_____,B 中官能团的名称是_____。
(2)由 B→C、E+H→I 的反应类型分别是_____、_____。
(3)G 的结构简式为_____。
(4)D→F 所需的试剂和反应条件是_____。
(5)G 和 CH3CHO 反应生成 H 的化学方程式为_____。
(6)芳香化合物J是 E的同分异构体。若J 能发生银镜反应,则J 可能结构有______种(不含立体异构), 其中核磁共振氢谱有四组峰,且峰面积之比为 1:1:2:6 的结构简式为_____
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是极具发展潜力的清洁能源,氢气的开发和综合利用是目前全球重要的科研项目之一。回答下列问题:
(1)T℃时,向体积均为1L的甲、乙两个恒容容器中分别加入足量碳和0.1molH2O(g),发生反应:H2O(g)+C(s)CO(g)+H2(g) △H>0。甲容器控制绝热条件,乙容器控制恒温条件,两容器中压强随时间的变化如图所示。
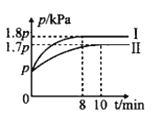
①图中代表甲容器的曲线为__(填“Ⅰ”或“Ⅱ”)。
②下列关于甲容器反应体系的说法错误的是__。
A.当水蒸气的体积分数不再发生变化,反应达到平衡状态
B.从密闭容器中分离出部分固体碳,H2的体积分数减小
C.缩小容器体积,平衡逆向移动,平衡常数减小
D.向平衡体系中充入少量水蒸气,再次平衡后,容器中c(CO)增大
③乙容器中,从反应开始到达平衡,v(H2O)=__molL-lmin-l;T℃下,该反应的平衡常数Kp=___(用含p的代数式表示)。
(2)对于反应aA(g)+bB(g)cC(g)+dD(g),速率方程v═kcm(A)cn(B),k为速率常数(只受温度影响),m+n为反应级数。已知H2(g)+CO2(g)CO(g)+H2O(g),CO的瞬时生成速率=kcm(H2)c(CO2)2。一定温度下,控制CO2起始浓度为0.25molL-1,改变H2起始浓度,进行以上反应的实验,得到CO的起始生成速率和H2起始浓度呈如图所示的直线关系。
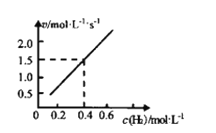
①该反应的反应级数为__。
②速率常数k=__。
③当H2的起始浓度为0.2molL-1,反应进行到某一时刻时,测得CO2的浓度为0.2molL-1,此时CO的生成瞬时速率v=__molL-ls-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学变化中的能量转换对于生产具有重大意义和研究价值。回答下列问题:
(l)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。

①过程Ⅰ能量__(填“释放”或“吸收”。
②已知:CO2(g)+H2(g)═CO(g)+H2O(g) △H═+41kJmol-1:
2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H═-128kJmol-1:
3CO2(g)+9H2(g)═C3H6(g)+6H2O(g) △H═+157.5kJmol-l
C2H4(g)+C3H6(g)+H2(g)═C5H12(异戊烷,g) △H=+267.6kJmol-1。
则5CO(g)+11H2(g)═C5H12(异戊烷,g)+5H2O(g)△H=__kJmol-1。
(2)一种铜版画雕刻用的酸性蚀刻液的有效成份是CuCl2,蚀刻反应为:Cu2++Cu+6Cl-═2CuCl32-。工业上用电解法将CuCl32-转化为Cu2+,使蚀刻液再生并回收金属Cu。装置如图(电极不参与反应)。

①再生的CuCl2蚀刻液为流出液__(填“a”或“b”)。
②写出N极的电极反应:__。
③装置中使用___离子交换膜(填“阳”或“阴”)。若电解池工作前,阴极室和阳极室中电解液质量相等,当转移0.1mol电子,流出液未流出时,两侧电解液的质量差为__g。
查看答案和解析>>
科目: 来源: 题型:
【题目】Zn(OH)2、ZnS分别为白色、淡黄色难溶物,二者溶解度均随温度升高而增大。某温度下,Ksp[Zn(OH)2]=1.0×10-18。向物质的量浓度相同的NaOH和Na2S的混合溶液中滴加ZnSO4溶液,溶液中阳离子、阴离子浓度关系如图所示。图中p(Zn)=-lgc(Zn2+),p(B)=-lgc(OH-)或-1gc(S2-)。下列说法错误的是( )
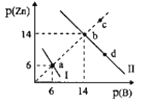
A.曲线l表示的是Zn2+与OH-浓度关系的曲线
B.该温度下,Ksp(ZnS)=1.0×10-28
C.升高温度时,b点一定会向c点移动
D.已知此温度下Ka2(H2S)═4.0×10-16,向0.01molL-lNaHS溶液中滴加等体积0.2molL-1ZnSO4溶液不能产生沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用,其中铁和铜是两种应用广泛的元素。
(1)基态铁原子的价电子轨道表达式为_____。
(2)磁性材料铁氧体在制备时常加入 CH3COONa、尿素[CO(NH2)2]等碱性物质。尿素分子中所含元素的电负性由小到大的顺序是_____,1mol 尿素分子中含有的 σ 键数目为_____。 CH3COONa 中碳原子的杂化类型为_________。
(3)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则 Fe(CO)5的晶体类型是_____,写出与CO互为等电子体的分子的电子式_____(任写一种)。
(4)CuO在高温时分解为 O2和 Cu2O,请从阳离子的结构来说明在高温时,Cu2O比 CuO更稳定的原因_____。
(5)磷青铜是含少量锡、磷的铜合金,某磷青铜晶胞结构如图所示:
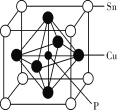
①其化学式为_____。
②若晶体密度为 8.82g/cm3,则最近的 Cu原子核间距为_____pm(用含 NA 的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料,也可作燃料。工业上可用CO2和H2在一定条件下合成甲醇。回答下列问题。
(1)已知:CO 和 H2 的燃烧热分别为 283.0 kJ·mol-1、285.8kJ·mol-1 ,水的汽化热为 44.0kJ·mol-1, 反应① CO+H2O=CO2+H2 是生成合成甲醇的原料气(CO2、H2)的重要反应,其热化学方程式为: CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =_____ kJ·mol-1。
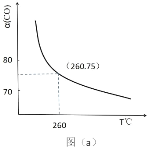
(2)某同学设计实验对反应①进行研究。将 1mol H2O(g)和 1mol CO 充入一个恒容密闭容器中,在催化剂和一定温度下达到化学平衡。如图是 CO 的平衡转化率(%)随温度变化的曲线,260℃时反应①的平衡常数 K=_______。
(3)CO2和 H2在催化剂、一定温度下合成甲醇。图为在容积为 1L 的恒容密闭容器中,加入 3 molH2和 1molCO2时经过相同时间甲醇产率与反应温度的关系曲线:
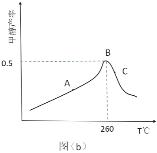
曲线上 A 点_____(填“是”或“不是”)对应温度下的平衡产率,理由是_____,C 点甲醇的产率低于 B 点的原因可能是_____(填标号)。
A.反应活化能增大 B.催化剂活性低 C.副反应多 D.平衡常数变大 E.平衡逆向移动
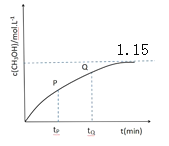
(4)CO和 H2在一定条件下也可以合成甲醇。在容积为1L的恒容密闭容器中,加入 a molH2和2.0molCO,在催化剂和 260℃温度条件下发生反应:CO+2H2=CH3OH。图为甲醇的浓度与反应时间的关系曲线,tP 时的 v 逆_____tQ 时的 v 逆(填大于、小于或等于),判断的依据是_____,达平衡时氢气的浓度为 1.0mol/L,则起始时加入的氢气的物质的量为_____mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,分别用 0.01mol/L 的 NaOH 溶液滴定与之等浓度的体积均为 25.00mL 的 HA、H3B(三元酸)溶液,溶液的 pH 随V(NaOH)变化曲线如图所示,下列说法错误的是
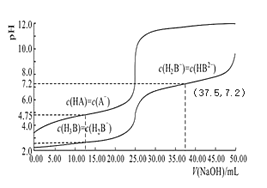
A.常温下 K(HA)数量级约为10-5
B.常温下 0.01mol/L 的 NaH2B溶液的 pH 大于 7
C.NaOH 溶液滴定 HA 溶液应选择酚酞作为指示剂
D.当横坐标为 37.50时,溶液中存在:2c(H+)+c(H2B-)+3c(H3B)=2c(OH-)+3c(B3-)+c(HB2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 M、N 是合成某功能高分子材料的中间产物,下列关于 M、N 说法正确的是
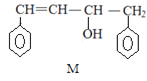
![]()
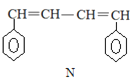
A.M、N 都属于芳香烃,但既不是同系物,也不是同分异构体
B.M、N 分别与液溴混合,均发生取代反应
C.M、N 均能使酸性高锰酸钾溶液褪色
D.M、N 分子所有原子均可能共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com