
科目: 来源: 题型:
【题目】短周期元素 W、X、Y、Z的原子序数依次增大。W的气态氢化物遇湿润的红色石蕊试纸变蓝色,X是地壳中含量最高的元素,Y在同周期主族元素中原子半径最大,Z 与 Y形成的化合物的化学式为YZ。下列说法不正确的是
A.W 在元素周期表中的位置是第二周期 VA 族
B.同主族中 Z 的气态氢化物稳定性最强
C.X 与 Y 形成的两种常见的化合物中,阳离子和阴离子的个数比均为 2∶1
D.用电子式表示 YZ 的形成过程为:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】瑞巴匹特为新型抗溃疡药,它可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如图:
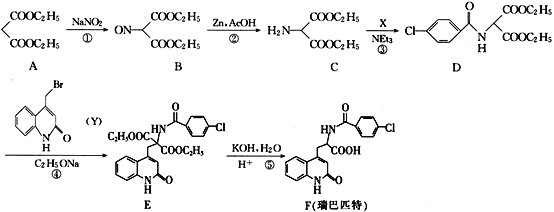
(1)A的化学名称为__,A与足量的NaOH溶液反应的化学方程式__。
(2)化合物D中含氧官能团的名称为__。
(3)反应①~④中,属于取代反应的是__(填序号)。
(4)C→D的转化中,生成的另一种产物为HCl,则X的结构简式为__。
(5)已知Y中的溴原子被-OH取代得到Z,写出同时满足下列条件的Z的一种同分异构体的结构简式:__。
Ⅰ.分子中含有一个苯环和一个五元环,且都是碳原子形成环;
Ⅱ.苯环上的一氯代物只有两种;
Ⅲ.能与NaHCO3溶液发生反应。
(6)已知:CH3CH2OH![]() CH3CH2Br,请写出以A和HOCH2CH2CH2OH为原料制备
CH3CH2Br,请写出以A和HOCH2CH2CH2OH为原料制备![]() 的合成路线流程图___(无机试剂任用)。
的合成路线流程图___(无机试剂任用)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 在0.1 molL-1Na2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深 | CO32-水解是吸热反应 |
B | 等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多 | 酸性A比B强 |
C | 常温下,用饱和Na2CO3溶液可将BaSO4部分转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH约为10;0.1 molL-1 NaHSO3溶液的pH约为5 | HSO |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。已知:BCl3的熔点为-107.3℃,沸点为12.5℃,遇水水解生成H3BO3和HCl,请回答下列问题:
(实验Ⅰ)制备BCl3并验证产物CO

(1)该实验装置中合理的连接顺序为G→_____→_____→_____→____→F→D→I。其中装置E的作用是___________________________。
(2)装置J中反应的化学方程式为____________________________________。
(实验Ⅱ)产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。发生反应:Ag+ +SCN- =AgSCN↓。
⑤重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2 mL。
已知: Ksp(AgCl)>Ksp(AgSCN) 。
(3)步骤④中达到滴定终点的现象为__________________。
(4)实验过程中加入硝基苯的目的是___________________。
(5)产品中氯元素的质量分数为_________________%。
(6)下列操作,可能引起测得产品中氯含量偏高是__________。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 反应CO2(g)+C(s)![]() 2CO(g)的△H<0,△S>0
2CO(g)的△H<0,△S>0
B. 钢铁水闸可用牺牲阳极或者外加电流的阴极保护法减缓其腐蚀
C. 常温下,KSP[Al(OH)3]=1×10-33。欲使溶液中c(Al3+)≤1×10-6 mol·L-1,需调节溶液的pH≥5
D. 常温常压下,11.2 L Cl2与足量铁粉充分反应,转移电子数为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置或操作设计正确,且能达到目的的是

A. 实验①,设计铜锌双液原电池
B. 实验②,将钢闸门与外接电源的负极相连,可防止钢闸门腐蚀
C. 实验③,准确量取一定体积K2CrO7标准溶液
D. 实验④,可用于验证酸性:H2SO4>H2CO3>HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离于方程式书写正确的是
A. 加热CuSO4溶液:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
B. 泡沫灭火器工作时的化学反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C. 以石墨为电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2+H2↑+OH-
Cl2+H2↑+OH-
D. 向NH4HCO3溶液中加入过量的NaOH(溶液)加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向0.1mol/LNH3·H2O溶液中通入HCl气体,溶液中![]() 与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是
与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是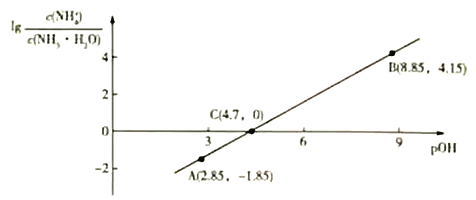
A. C点的溶液中:c(NH3·H2O)>c(NH4+)
B. pOH=7的客液中的溶质是NH4Cl
C. pOH=3的客液中:c(NH4+)+c(H+)+c(NH3·H2O)-c(OH-)=0.1mol/L
D. NH3·H2O的Kb=1.0×10-4.7
查看答案和解析>>
科目: 来源: 题型:
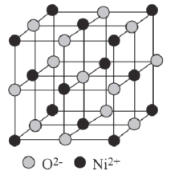
【题目】据报道,我国化学研究人员用Ni(NO3)2和Tb(CH3COO)3等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。

请回答下列问题:
(1)基态Ni原子的价电子轨道表达式为____________,Ni在元素周期表中处于第____________纵行。
(2)C、N、O三种元素中电负性最大的是____(填元素符号),C在形成化合物时,其键型以共价键为主,原因是_____________。
(3)Ni(NO3)2中阴离子的空间构型是______,写出与该阴离子互为等电子体的一种分子的化学式:________。
(4)一维链状配位聚合物中,碳原子的杂化形式为________________________。
(5)已知: CH3COOH的沸点为117.9℃, HCOOCH3的沸点为32℃,CH3COOH的沸点高于 HCOOCH3的主要原因是______。
(6)已知:氧化镍的晶胞结构如图所示。
①若NA为阿伏加德罗常数的值,晶体密度为ρg·cm-3,则该晶胞中最近的O2-之间的距离为____pm(用含ρ、NA的代数式表示)。
②某缺陷氧化镍的组成为 Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中的总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),计算△H=___。反应原料来自煤的气化。已知该反应的平衡常数表达式为K=
CH3OCH3(g)+CO2(g),计算△H=___。反应原料来自煤的气化。已知该反应的平衡常数表达式为K=![]() ,每生成1molH2需要吸收131.3kJ的热量。写出该反应的热化学方程式___。
,每生成1molH2需要吸收131.3kJ的热量。写出该反应的热化学方程式___。
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L-1,c(H2)=1.4mol·L-1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为___。
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol·L-1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)
CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)

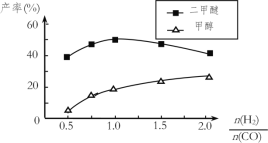
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比![]() 的改变二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:__。
的改变二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com