
科目: 来源: 题型:
【题目】2019年 11月《Science》杂志报道了王浩天教授团队发明的制取 H2O2 的绿色方法,原理如图所示(已知:H2O2![]() H++HO2-,Ka=2.4×10-12。下列说错误的是( )
H++HO2-,Ka=2.4×10-12。下列说错误的是( )
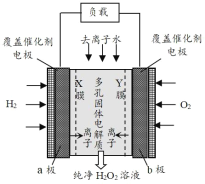
A.X膜为阳离子交换膜
B.每生成 1mol H2O2外电路通过4mol e-
C.催化剂可加快单位时间内反应中电子的转移数目
D.b极上的电极反应为:O2+ H2O + 2e- = HO2 + OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示实验装置,能达到对应实验目的或现象描述正确的是( )
A. 所示装置用于 Cu 和浓 H2SO4 制取少量的 SO2 气体
所示装置用于 Cu 和浓 H2SO4 制取少量的 SO2 气体
B.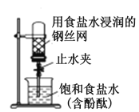 打开图中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
打开图中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
C.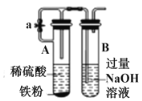 利用图所示装置制取 Fe(OH)2
利用图所示装置制取 Fe(OH)2
D.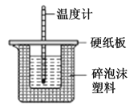 利用图测定中和反应反应热
利用图测定中和反应反应热
查看答案和解析>>
科目: 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液.根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O═Cu2O+2Ag,下列有关说法正确的是( )

A.2molCu与1molAg2O的总能量低于1molCu2O与2molAg具有的总能量
B.负极的电极反应式为2Cu+2OH--2e-═Cu2O+H2O
C.测量原理示意图中,电流方向从Cu→Ag2O
D.电池工作时,OH-向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】CO和H2在一定条件下合成甲醇的反应为;CO(g)+2H2(g)![]() CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
CH3OH(g) △H1。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃ 、500℃的密闭容器中,甲醇的物质的量:图2:温度分别为Tl~T5的密闭容器中,反应均进行到5min时甲醇的体积分数)。下列叙述正确的是
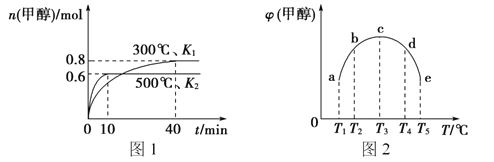
A. 该反应的△H1>0,且K1>K2
B. 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压
C. 300℃时,向平衡后的容器中再充入0.8molCO, 0.6molH2,0.2molCH3OH,平衡正向移动
D. 500℃时,向平衡后的容器中再充入1molCH3OH,重新平衡后,H2浓度和百分含量均增大
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.6.0gSiO2晶体中含有共价键的数目为 0.2NA
B.标准状况下,22.4L甲醇中含有的 C-H 键数目为 0.3NA
C.室温下,53.5gNH4Cl晶体溶于氨水中,所得溶液 pH=7,NH![]() 的数目为NA
的数目为NA
D.用铅蓄电池电解氯化钠溶液,得到22.4L H2,铅蓄电池中消耗氢离子数为4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
0 | 2.00 | 2.00 | 0 |
2 | 0.80 | ||
4 | 1.20 |
下列说法正确的是( )
A.反应在0~2min内的平均速率为v(SO2)=0.6molL-1min-1
B.反应在2~4min内容器内气体的密度没有变化
C.若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D.保持其他条件不变,起始时向容器中充入1.00molMgSO4和1.00molCO,到达平衡时n(CO2)<0.60mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的溶解平衡曲线如图所示,下列说法不正确的是( )
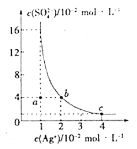
A.b点对应的Ksp(Ag2SO4)等于c点对应的Ksp(Ag2SO4)
B.采取蒸发溶剂的方法可以使a点对应的溶液变为b点对应的溶液
C.该温度下,Ksp(Ag2SO4)=1.6×10-5
D.0.02molL-1的AgNO3溶液与0.2molL-1的Na2SO4溶液等体积混合不会生成沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z是同周期主族元素,Y 的最外层电子数是 X 次外层电子数的 3倍,四种元素与锂组成的盐是一种新型电池的电解质(结构如图,箭头指向表示共用电子对由 W 提供)。下列说法不正确的是( )
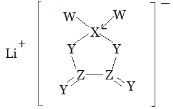
A.W的非金属性比Y的强
B.原子半径Z比X大
C.该物质中含离子键和共价键
D.该物质中Ⅹ原子满足8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。以氟碳铈矿(主要含 CeFCO3)为原料制备 CeO2 的一种工艺流程如下:
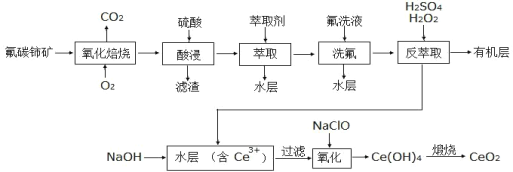
已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F—能和很多金属离子形成较为稳定的配合物,如Ce4+能与 F—结合成CeF3+,Al3+也能与 F—结合成 AlF63-;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
③Ce4+能被萃取剂 TBP 萃取,而 Ce3+不能。回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____。
(2)氧化焙烧后的固体产物中含有 CeO2 和 CeF4 物质的量之比为 3:1,“酸浸”时发生反应的离子方程式为_____________。传统工艺中用盐酸替代硫酸,其缺点为________________。
(3)TBP是一种有机萃取剂,“萃取”时存在反应CeF3++TBP![]() CeTBP4++F-,氟洗液中添加 Al3+的作用是________________。
CeTBP4++F-,氟洗液中添加 Al3+的作用是________________。
(4)“反萃取”步骤中发生反应的离子方程式为________________。
(5)反萃取后的水层溶液中 c(Ce3+)=1mol/L,c(Al3+)= 0.01mol/L,应先加入 NaOH 溶液调节溶液的___<pH<_______ ,除去 Al3+后,再加入 NaOH 调节溶液的 pH 大于_____(保留一位小数),即可确保 Ce3+已完全沉淀。(已知:常温下,当溶液中的某离子浓度小于 1.0×10-5mol·L-1时,可认为该离子沉淀完全。Ksp[Al(OH)3]=1.0×10-32,Ksp[Ce(OH)3]=1.0×10-21)。
(6)CeO2是汽车尾气净化催化剂的关键成分,在尾气消除过程中发生着 CeO2 与 CeO2(1-x) (0≤x≤0.25)的相互转化。写出 CeO2 消除 CO尾气的化学方程式:______________。
(7)CeO2(1-x)中的 Ce为+3、+4 价,测定 x的值可判断它们的比例。现取 CeO2(1-x)固体 0.8280 g,加入足量硫酸和 0.0110 molFeSO4·7H2O充分溶解,使 Ce4+全部被还原成 Ce3+,再用 0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗 20.00 mL 标准溶液。(已知氧化性:Ce4+>KMnO4)
①x的值为_____。
②若加入的 FeSO4·7H2O 部分变质,会导致测定的 x 值_____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)可作为贮存水果的保鲜剂。现欲制备焦亚硫酸钠并探究其部分化学性质。
Ⅰ.制备Na2S2O5
可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体(试剂不重复使用)。
焦亚硫酸钠的析出原理:2NaHSO3(饱和溶液)=Na2S2O5(晶体)+H2O(l)
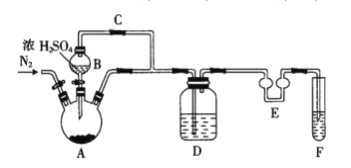
(1)如图装置中仪器A的名称是___。A中发生反应的化学方程式为___。仪器E的作用是___。
(2)F中盛装的试剂是___。
Ⅱ.探究Na2S2O5的还原性
(3)取少量Na2S2O5晶体于试管中,滴加1mL2mol/L酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去。反应的离子方程式为___。食品级焦亚硫酸钠可作为贮存水果保鲜剂的化学原理是防止食品___。
Ⅲ.测定Na2S2O5样品的纯度。
(4)将10.0gNa2S2O5样品溶解在蒸馏水中配制100mL溶液,取其中10.00mL加入过量的20.00mL0.3000mol/L的酸性高锰酸钾溶液,充分反应后,用0.2500mol/L的Na2SO3标准液滴定至终点,消耗Na2SO3溶液20.00mL,Na2S2O5样品的纯度为___%(保留一位小数),若在滴定终点时,俯视读数Na2SO3标准液的体积,会导致Na2S2O5样品的纯度___。(填“偏高”、“偏低”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com