
科目: 来源: 题型:
【题目】磷的含氧酸有磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)等多种,它们在工业上都是重要的化工原料。
(1)亚磷酸(H3PO3)是一种二元弱酸,写出H3PO3与过量NaOH溶液反应的化学方程式:_______。某温度下,0.01 mol L-1 H3PO3溶液的pH为2.7,该温度下,H3PO3 的一级电离常数 Kal=_______。 (已知:lg2 = 0.3,lg3 = 0.5,lg5 = 0.7,H3PO3 的第二步电离忽略不计)
(2)某实验小组用NaOH溶液处理含H3PO3废水,当溶液中c (Na+) =c(H2PO3-) + 2c(HPO32-)时,溶液呈______性(填“酸”“碱”或“中”)。
(3)已知:常温下,磷酸(H3PO4)的 Kal=7.ll×10-3、Ka2 = 6.23×10-8、Ka3 = 4.5 ×10-13, 则常温下,Na2HPO4溶液中H2PO4-、HPO42-和PO43-的浓度由大到小的顺序为________。
(4)向某浓度的磷酸溶液中滴加NaOH溶液,其pH与溶液中H3PO4、H2PO4-、HPO42-和PO43-的物质的量分数为δ (平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是_________。

(5)已知:常温下,Ksp(FePO4) = l.3×10-22、Ksp(A1PO4) = 5.2 ×10-19。常温下,向含Fe3+、A13+的混合溶液中滴加Na3PO4溶液,当FePO4、AlPO4同时生成时,溶液中c(Fe3+):c(Al3+ ) =_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上将石灰石和硫煤混合使用,称之为“固硫”,其反应原理为:2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
已知:CaO(s)+CO2(g)![]() CaCO3(s) △H2=bkJ·mol-1;
CaCO3(s) △H2=bkJ·mol-1;
2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
请回答下列问题:
(1)CaSO4(s)![]() CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
(2)T1℃时,向某恒容密闭容器中通入一定量的CO2和足量CaO发生反应:CaO(s)+CO2(g)![]() CaCO3(s),CO2的浓度随时间变化如图所示:
CaCO3(s),CO2的浓度随时间变化如图所示:

①0~8min,v(CO2)=___。
②t1min时,若保持其他条件不变,压缩容器体积至原来的![]() ,t2min重新达到平衡,请在图中画出CO2的浓度自条件改变至新平衡的变化曲线___。
,t2min重新达到平衡,请在图中画出CO2的浓度自条件改变至新平衡的变化曲线___。
(3)T2℃时,向某密闭容器中通入2molSO2和1molO2发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
①若该容器为恒压密闭容器,下列选项可判断反应已达平衡状态的是___。
A.混合气体的密度不再改变
B混合气体的压强不再改变
C.相同时间内,每断裂0.1molO=O键,同时生成0.2molSO3
D.混合气体的平均相对分子质量不再改变
②若该容器为2L的恒容密闭容器,达平衡时SO3的体积分数为40%,则O2的转化率为___,T2℃时该反应的平衡常数K=___。
③反应达到②中的平衡状态后,保持反应温度和O2的浓度不变,增大容器体积,则平衡将___(填“正向”、“逆向”或“不“)移动,原因为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2中的c(NH![]() )________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH
)________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是___________________;
②20℃时,0.1 mol/L NH4Al(SO4)2中2c(SO![]() )-c(NH
)-c(NH![]() )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol/L NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
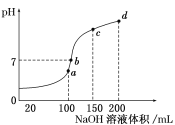
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)101kPa下,1g氢气完全燃烧生成液态水放出142.9kJ热量,氢气的燃烧热△H =_______;氢气燃烧的热化学方程式为_______。
(2)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
①倒入NaOH溶液的正确操作是________(填选项字母,下同)。
A.沿玻璃棒缓慢倒入
B.一次性迅速倒入
C.分三次少量倒入
②使硫酸与NaOH溶液混合均匀的正确操作是_______。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)工业合成氨反应为N2(g)+3H2(g)2NH3(g),一定条件下,在2 L密闭容器中进行实验,测得有关数据如下表所示:
物质 | N2(g) | H2(g) | NH3(g) |
起始(mol) | 2 | 7 | 0 |
10 s(mol) | 1.6 | ||
平衡时(mol) | 2 |
则010 s内,用氢气的浓度变化表示的平均反应速率是_______,该反应的化学平衡常数是_________。根据混合气体各成分的物质性质,你认为工业上将氨气从混合气体中分离出来的措施是_______ ,从而达到反应气体循环利用的目的。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ/mol,在温度、容积均相同的 3 个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol O2、2mol SO2 | 2mol SO3 | 1mol SO3 |
SO3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) |
|
|
|
反应物转化率 | α1 | α2 | α3 |
下列说法不正确的是
A.c1>2c3B.a+b=196.6
C.p2>2p3D.α1+α3>1
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示:

请回答下列问题:
(1)D在元素周期表中的位置为___。
(2)A和C形成的一种摩尔质量为41g·mol-1的化合物,该化合物与盐酸反应能生成两种盐,其化学方程式为___。
(3)M为A的简单气态氮化物,其水溶液可作刻蚀剂H2O2的清除剂,反应的产物不污染环境,其化学方程式为___。N为A的另一种氢化物,其相对分子质量比M大15,N为二元弱碱,在水中分步电离,并与M的电离方式相似,则N第一步电离的电离方程式为___,N与过量硫酸反应生成的酸式盐的化学式为___。
(4)下列事实能说明E元素的非金属性比D元素的非金属性强的是___ (填序号)。
①E的单质与D的气态氢化物的水溶液反应,生成淡黄色沉淀
②E与H2化合比D与H2化合更容易
③D与Fe化合时产物中Fe为+2价,E与Fe化合时产物中Fe为+3价
④等浓度的D和E的最高价含氧酸的水溶液中的c(H+):D>E
(5)D2E2分子中各原子最外层均满足8电子结构,则D2E2的电子式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对X2 (g)+3Y2 (g)=2XY3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量),下列判断正确的是
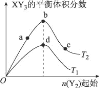
A.若T2>T1,则正反应一定是放热反应
B.T2和n (X2)不变,达到平衡时,XY3的物质的量:c>b>a
C.T2和n(X2)不变,达到平衡时,X2的转化率:b>a>c
D.若T2>T1,达到平衡时b、d点的正反应速率:v(d)>v (b)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下H2A的K1=1.0×10-4,K2=5.0×10-7。向20mLlmol·L-1的H2A溶液中逐滴滴入2mol·L-1的NaOH溶液,溶液中水电离出的c水(OH-)随加入NaOH溶液的体积V的变化如图所示,下列分析正确的是( )
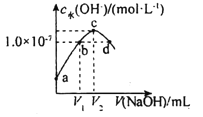
A.V1<10,V2=20
B.a点溶液的pH=3
C.c点溶液c水(H+)≈1.0×10-4mol·L-1
D.b、d点溶液均呈中性
查看答案和解析>>
科目: 来源: 题型:
【题目】向温度为300℃的2 L密闭容器中充入2 mol SO2和1 mol O2,发生反应2SO2 (g)+ O2 (g) ![]() 2SO3(g)△H<0,体系达到平衡状态后SO2的浓度为0.1 mol/L,下列说法错误的是
2SO3(g)△H<0,体系达到平衡状态后SO2的浓度为0.1 mol/L,下列说法错误的是
A.该温度下,反应的平衡常数K =1620
B.SO2和O2的平衡转化率相等
C.平衡后保持温度和容器体积不变,再充入SO3(g),平衡常数不变
D.若不再向容器中加入任何物质,仅改变条件不可能使SO2的浓度达到1 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表述与示意图一致的是
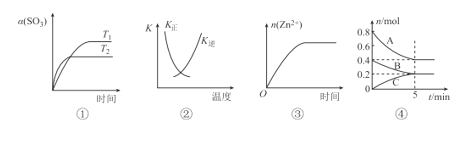
A.图①表示2SO3(g)=2SO2(g)+O2(g) △H>0,SO3的平衡转化率随温度、时间的变化
B.图②中曲线表示反应H2(g)+I2(g)=2HI(g) △H<0正、逆反应的平衡常数K随温度的变化
C.图③表示20 mL 0.1 mol/L稀盐酸与过量锌粒混合时,n(Zn2+)随时间的变化
D.图④反应从开始到平衡的平均反应速率v(B)=0.04molL-1min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com