
科目: 来源: 题型:
【题目】碳钢广泛应用在石油化工设备管道等领域,随着深层石油天然气的开采,石油和天然气中含有的CO2及水引起的腐蚀问题(俗称二氧化碳腐蚀)引起了广泛关注。深井中二氧化碳腐蚀的主要过程如下所示:
负极:![]() (主要)
(主要)
正极:![]() (主要)
(主要)
下列说法不正确的是
A.钢铁在CO2水溶液中的腐蚀总反应可表示为![]()
B.深井中二氧化碳对碳钢的腐蚀主要为化学腐蚀
C.碳钢管道在深井中的腐蚀与油气层中盐份含量有关,盐份含量高腐蚀速率会加快
D.腐蚀过程表明含有CO2的溶液其腐蚀性比相同pH值的HCl溶液腐蚀性更强
查看答案和解析>>
科目: 来源: 题型:
【题目】科学研究证明:核外电子的能量不仅与电子所处的电子层、能级有关,还与核外电子的数目及核电荷数有关。氩原子与硫离子的核外电子排布相同,都是![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.两粒子的1s能级上电子的能量相同
B.两粒子的3p能级上的电子离核的距离相同
C.两粒子的电子发生跃迁时,产生的光谱不同
D.两粒子最外层都达8电子稳定结构,化学性质相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作、现象和结论均正确,且存在对应关系的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到AlC13溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
B | NaHCO3溶液与NaAlO溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
C | 向盛有Na2SiO3,溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
D |
| 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】(12分)电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成.下列装置是用燃烧法确定有机物分子式常用的装置.

(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是
(2)C装置中浓硫酸的作用是 .
(3)D装置中MnO2的作用是 .
(4)燃烧管中CuO的作用是 .
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为 .
(6)用质谱仪测定其相对分子质量,得如图二所示的质谱图,则该有机物的相对分子质量为 .
(7)能否根据A的实验式确定A的分子式 (填“能”或“不能”),若能,则A的分子式是 (若不能,则此空不填).
(8)该物质的核磁共振氢谱如图三所示,则其结构简式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】硼铁混合精矿含有硼镁石[MgBO2(OH)、磁铁矿(Fe3O4)、磁黄铁矿(FexS)、品质铀矿(UO2)等,以该矿为原料制备MgSO4·H2O和硼酸(H3BO3)的工艺流程如下:
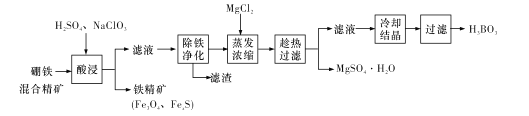
已知:![]() 在pH为4~5的溶液中生成UO2(OH)2沉淀。
在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:
(l)“酸浸”时,为了提高浸出率可采取的措施有:________ (至少答两个措施),该步骤中NaC1O3可将UO2转化为![]() ,则该反应的离子方程式为_____。
,则该反应的离子方程式为_____。
(2)“除铁净化”需要加入____(填化学式)把溶液pH调节至4~5,滤渣的成分是_______。
(3)“蒸发浓缩”时,加入固体MgC12的作用是 ___。
(4)铁精矿(Fe3O4、FexS)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃,
![]() ,
,![]() ,
,![]() 回答下列问题:
回答下列问题:
①在T℃,假设Fe3+水解的离子方程式是:![]() ,则该条件下Fe3+水解反应的平衡常数K= __(用含以的字母表示)。
,则该条件下Fe3+水解反应的平衡常数K= __(用含以的字母表示)。
②在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的c(Fe2+)/c(Fe3+)会 __(填“变大”“变小”或“不变”),请结合相关数据推理说明:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】G是具有抗菌作用的白头翁素衍生物,其合成路线如下:

(1)C中官能团的名称为________和________。
(2)E→F的反应类型为________。
(3)D→E的反应有副产物X(分子式为C9H7O2I)生成,写出X的结构简式:________________。
(4) F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:__________________。
①能发生银镜反应;
②碱性水解后酸化,其中一种产物能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
(5)请写出以乙醇为原料制备![]() 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组由Cu(NO3)2溶液先制得Cu(NO3)2·3H2O晶体,然后在下图所示实验装置中(夹持及控温装置省略),用Cu(NO3)2·3H2O晶体和SOCl2制备少量无水Cu(NO3)2。已知:SOCl2的熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体。
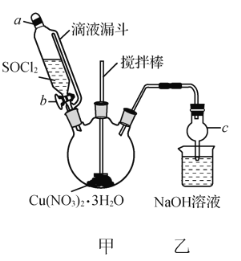
(1)由Cu(NO3)2溶液制得Cu(NO3)2·3H2O晶体的实验步骤包括蒸发浓缩、冷却结晶、抽滤等步骤。
①蒸发浓缩时当蒸发皿中出现______________________________(填现象)时,停止加热。
②为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是_______________(填一种)。
(2)①仪器c的名称是________。
②向三颈烧瓶中缓慢滴加SOCl2时,需打开活塞________(填“a”或“b”或“a和b”)。
(3)装置甲中Cu(NO3)2·3H2O和SOCl2发生反应的化学方程式为__________________________________。
(4)装置乙的作用是______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘酸钙[Ca(IO3)2]是重要的食品添加剂。实验室制取Ca(IO3)2·H2O的实验流程:
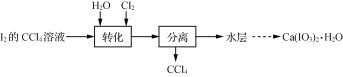
已知:碘酸是易溶于水的强酸,不溶于有机溶剂。
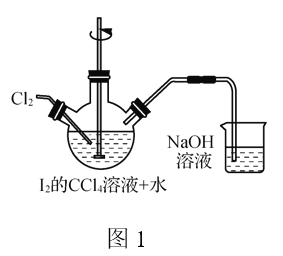
(1) 转化步骤是为了制得碘酸,该过程在图1所示的装置中进行,当观察到反应液中紫红色接近褪去时,停止通入氯气。
①转化时发生反应的离子方程式为_____________________________________。
②转化过程中CCl4的作用是_______________________________________。
③为增大转化过程的反应速率,可采取的措施是_______________________。
(2)将CCl4与水层分离的玻璃仪器有烧杯、________。除去HIO3水溶液中少量I2单质的实验操作为______________________________,直至用淀粉溶液检验不出碘单质的存在。
(3)已知:①Ca(IO3)2·6H2O是一种难溶于水的白色固体,在碱性条件下不稳定。
②Ca(IO3)2·6H2O加热升温过程中固体的质量变化如图2所示。
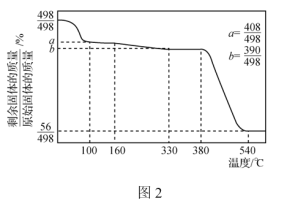
设计以除碘后的水层为原料,制取Ca(IO3)2·H2O的实验方案:向水层中__________。[实验中必须使用的试剂:Ca(OH)2粉末、AgNO3溶液]。
查看答案和解析>>
科目: 来源: 题型:
【题目】过碳酸钠是一种多用途的新型漂白剂,化学式可表示为aNa2CO3·bH2O2,过碳酸钠溶于水分解成Na2CO3和H2O2。
(1)FeOCl常用作过碳酸钠使用时的催化剂。FeCl3·6H2O在250℃时分解可得到FeOCl,该反应的化学方程式为______________________________________。
(2)测定某样品中过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
步骤Ⅰ:称取样品0.800 0 g于锥形瓶中,加水溶解,滴加甲基橙作指示剂,用0.200 0 mol·L-1H2SO4溶液滴定至终点,消耗硫酸25.00 mL。
步骤Ⅱ:另称取样品0.800 0 g于锥形瓶中,加水溶解,加稀硫酸酸化,用0.100 0 mol·L-1 KMnO4溶液滴定至终点(滴定过程中MnO被还原为Mn2+),消耗KMnO4溶液30.00 mL。
①步骤Ⅰ中,滴定终点的现象是____________________。
②步骤Ⅱ中,若样品溶于水酸化后放置一段时间,然后再进行滴定,则过碳酸钠化学式中a∶b的测定结果将________(填“偏大”“偏小”或“无影响”)。
③通过计算确定该过碳酸钠化学式(写出计算过程)。___________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)B的轨道排布式是_____________________________________,A、B、C、D的第一电离能由小到大的顺序为___________________________________________。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________;
(3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com