
科目: 来源: 题型:
【题目】前四周期元素X、Y、Z、W、Q的原子序数依次增大。X与Y同周期且相邻,Y的基态原子的s电子数与p电子数相等,Z是地壳中含量最多的金属元素,W的原子核外价电子排布式为![]() ,Q的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是( )
,Q的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是( )
A.简单气态氢化物的稳定性:Y>X
B.简单离子的半径:Z>X>Y
C.Z的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
D.由Y、W、Q三种元素形成的某种化合物可用于检查司机是否酒后驾车
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表前四周期的一部分如表所示,下列有关![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种元素的叙述正确的是( )
五种元素的叙述正确的是( )
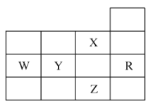
A.![]() 元素的最高价含氧酸的酸性强于
元素的最高价含氧酸的酸性强于![]() 元素的最高价含氧酸
元素的最高价含氧酸
B.![]() 、
、![]() 的阴离子电子层结构都与
的阴离子电子层结构都与![]() 原子的相同
原子的相同
C.![]() 能级未成对电子数最多的是
能级未成对电子数最多的是![]() 元素
元素
D.![]() 元素是电负性最大的元素
元素是电负性最大的元素
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向20mL0.1mol/LH2R溶液中滴加0.1mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知pKa = –lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21.下列有关说法错误的是
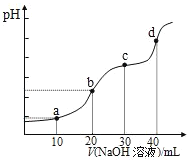
A.H2R + R22HR平衡常数K>105,反应趋于完全
B.常温下,Kh(HR-)的数量级为10-13
C.点b时,pH<7且 c(R2)·c(H+)<c(H2R)·c(OH)
D.点c时,溶液中2c(OH)-2c(H+)=3c(H2R)+ c(HR)-c(R2)
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素X的气态氢化物在高温下分解为固态的X单质和H2,分解反应前后气体的质量之比是17:1。下列有关叙述中错误的是
A. X的阴离子的电子排布式是1s22s22p63s23p6
B. X的最高价氧化物对应的水化物的酸性比砷酸强
C. X的最高价氧化物中,X的质量分数为50%
D. X的气态氢化物的水溶液呈酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是四种短周期元素,
是四种短周期元素,![]() 、
、![]() 、
、![]() 同周期,
同周期,![]() 、
、![]() 同主族。
同主族。![]() 的原子结构示意图为
的原子结构示意图为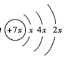 ,
,![]() 、
、![]() 形成的化合物的电子式为
形成的化合物的电子式为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.原子半径:![]()
B.电负性:![]()
C.原子序数:![]()
D.最高价氧化物对应水化物的酸性:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是

A. M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 理论上每生成1 mol H3BO3,两极室共产生标准状况下16.8 L气体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列描述中正确的是( )
A. 氮原子的价电子排布图:![]()
B. 2p和3p轨道形状均为哑铃形,能量也相等
C. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
查看答案和解析>>
科目: 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是
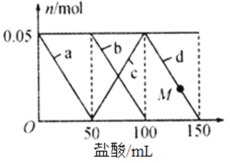
A.b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B.结合H+的能力:AlO2>CO32> HCO3>Al(OH)3
C.原混合溶液中,CO32与AlO2的物质的量之比为2∶1
D.M点时A1(OH)3的质量等于3.9 g
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向1L 0.1mol·L1一元酸HR溶液中逐渐通入氨气(已知常温下NH3·H2O电离平衡常数K=1.76×10-5),使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
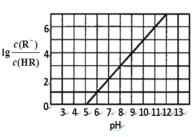
A.当c(R-)=c(HR)时,溶液必为中性
B.0.1mol·L-1HR溶液的pH为5
C.HR为弱酸,常温时随着氨气的通入,![]() 逐渐增大
逐渐增大
D.当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取M g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取50.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取50.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 50.00 | 50.00 | 50.00 | 50.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和_______、________。
(2)操作I为______________,操作Ⅱ为______________。
(3)在方案Ⅱ中滴定终点的判断方法是_______________________________。
(4)在方案Ⅱ中发生的离子反应方程式为____________________________。
(5)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为___________。(写成分数形式)
(6)方案Ⅱ中氧化还原滴定过程中,导致待测液Na2SO3浓度变小的是_____(填序号)。
a.用碱式滴定管量取50mL待测液过程时,开始仰视,滴定结束时俯视
b.用碱式滴定管量取50mL待测液过程时,一开始有气泡,滴定结束后没气泡
c.酸式滴定管用蒸馏水润洗后,没有用酸性KMnO4溶液多次润洗
d.锥形瓶用蒸馏水润洗后,直接装50.00mL的待测液
e.滴定过程时,开始时平视,滴定结束时仰视
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com