
科目: 来源: 题型:
【题目】下列关于铁的腐蚀和防护的叙述正确的是( )
A.用铁锅烧制糖醋鱼时,铁锅会发生化学腐蚀和析氢腐蚀
B.铁发生吸氧腐蚀的负极反应可用O2+4e-+2H2O=4OH-表示
C.常温下,铁在浓硫酸中比在稀硫酸中腐蚀得快
D.可用如图表示对钢铁采取外加电流的阴极保护法的原理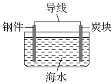
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中正确的是
A.25 ℃时,0.1 mol·L-1 HF溶液中pH=1B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生D.该体系中,Ksp(CaF2)=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),下列说法正确的是
CuS(s)+Mn2+(aq),下列说法正确的是
A.该反应达到平衡时,c(Mn2+)=c(Cu2+)
B.该反应达到平衡时,Ksp(CuS)较大
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)减小
D.该反应的平衡常数K=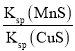
查看答案和解析>>
科目: 来源: 题型:
【题目】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的状态(不考虑二氧化碳的溶解),则电解过程中共转移电子的物质的量为
A.0.4 molB.0.5 molC.0.6 molD.0.8 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列转化过程分析不正确的是( )
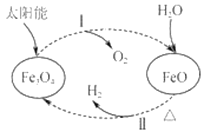
A.Fe3O4中Fe元素的化合价为+2、+3
B.过程Ⅰ中每消耗58gFe3O4转移1mol电子
C.过程Ⅱ的化学方程式为3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D.该过程总反应为2H2O=2H2↑+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( )
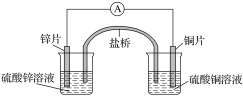
A. 电子从锌电极通过电流表流向铜电极
B. 盐桥中的阴离子向硫酸铜溶液中迁移
C. 锌电极发生氧化反应;铜电极发生还原反应,其电极反应是2H++2e-===H2↑
D. 取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】在CH3COONa溶液里,加入下列物质使水解平衡向左移动,并且pH变大的是 ( )
A. 加入适量纯CH3COOH
B. 加入少量NaCl固体
C. 加入少量NaOH固体
D. 加水稀释
查看答案和解析>>
科目: 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
(1)该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2 g。则10min内CO的平均反应速率为________。
(2)请用上述反应中某种气体的有关物质理量来说明该反应已达到平衡状态:
①____________________________________________________;
②____________________________________________________。
(3)写出氢氧化铝在水中发生碱式电离的电离方程式:________________;欲使上述体系中铝离子浓度增加,可加入的物质是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为________。
(2)硫酸铝溶液与过量氨水反应的离子方程式为_______________________________。
(3)能证明Na2SO3溶液中存在SO32-+H2OHSO3-+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(4)某学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂。盛装0.2000 mol/L盐酸标准液应该用______________式滴定管;用盐酸滴定待测液NaOH,滴定终点时的颜色变化是_____________且30s不变色。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
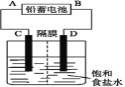
已知:铅蓄电池在放电时发生下列电极反应:
负极Pb+SO42--2e- =PbSO4
正极PbO2+4H++SO42-+2e- =PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式_________________________。
(2)若在电解池C极一侧滴酚酞溶液,电解一段时间后未呈红色,说明铅蓄电池的A极为____极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量、密度为1.15 g/cm-3)时,
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________ mol。
②铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为__________L。
③消耗硫酸a mol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出)__________________________________(用含a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com