
科目: 来源: 题型:
【题目】1887年,英国人赫勒森发明了最早的干电池,如今干电池已经发展成为一个庞大的家族,种类达100多种。应用广泛的是Zn—MnO2干电池,其电解质溶液是ZnCl2—NH4Cl混合溶液。电池工作一段时间后,电池内存在7种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O。请回答下列问题
(1)该电池的负极材料是__;电池工作时,电子流向__(填“正极”或“负极”,下同);放电时NH4+向___移动。
(2)该氧化还原反应的化学方程式为__,发生还原反应的物质是__,被氧化的元素是__。若有17.4g氧化剂参与反应,则电子转移数目为__NA(NA表示阿伏加德罗常数的值)。
(3)普通锌锰电池的缺点是电量小、放电电流弱。为增大放电电流,可把负极锌片改为锌粉,其理由是___。
(4)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__。欲除去Cu2+,最好选用下列试剂中的__(填序号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
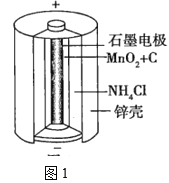
(1)锌锰干电池是应用最普遍的电池之一,图1为锌锰干电池的构造示意图,锌锰干电池的负极材料是___(填物质名称),负极发生的电极反应为___。若反应消耗32.5g负极材料,则电池中转移电子的数目为___。
(2)目前常用的镍-镉(Ni—Cd)可充电电池的总反应式可表示为Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是___(填序号)。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是___(填序号)。
①该电池可以在酸性条件下进行充、放电。
②该电池放电时,负极的电极反应式为Cd+2OH--2e-=Cd(OH)2
③该电池放电时,Cd极的质量减少
④该电池放电时,化学能转变为电能。
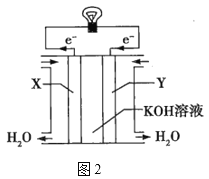
(3)图2为氢氧燃料电池的构造示意图,电解质溶液是KOH溶液。则X极为电池的__(填“正”或“负”)极,X极的电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池方面获得新突破,研制出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。(已知:质子交换膜的作用是只允许H+通过;甲醇在氧气中燃烧生成CO2和H2O。)

(1)该电池工作时,b处通入的物质为__,c处通入的物质为___。
(2)该电池负极的电极反应式为__。
(3)该电池工作一段时间后,当12.8g甲醇完全反应时,有___mol电子发生转移。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁电池是一种新型可充电电池该电池能较长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
(1)高铁电池的负极材料是___。
(2)放电时,正极发生__(填“氧化”或“还原”)反应;负极的电极反应式为__。
(3)放电时,__(填“正”或“负”)极附近溶液的碱性增强。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。碳是地球上组成生命的最基本的 元素之一。按要求回答:
(1)宇宙中含量最多的元素是氢和______。基态碳原子的核外电子占有______个原子轨道。
(2)光化学烟雾中除了含有 NOx 外,还含有 HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN 中 C 的杂化方式有______。1mol PAN 中含有的σ键数目为______。组成PAN 的元素的电负性大小顺序为______。
②相同压强下,HCOOH 的沸点比 CH3OCH3______(填“高”或“低”),
(3)水溶液中有 H3O+、H5O2+ 、H9O4 + 等微粒的形式。请画出 H5O2 的结构式:______。
(4)硅和碳在同一主族。下图为 SiO2 晶胞中 Si 原子沿 z 轴方向在 xy 平面的投影图(即俯视图),其 中 O原子略去,Si 原子旁标注的数字表示每个 Si 原子位于 z 轴的高度,则 SiA 与 SiB 之间的距离是______nm。
 (d 的单位为 nm)
(d 的单位为 nm)
查看答案和解析>>
科目: 来源: 题型:
【题目】碳排放是影响气候变化的重要因素之一。最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。下列有关说法中不正确的是( )
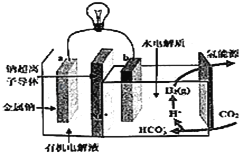
A. 系统工作时,化学能转变成电能
B. 系统工作时,电流由a极沿导线流向b极
C. 系统工作时,b极区可能会析出固体
D. 系统工作时,b极区的电极反应式为2CO2+2H2O+2e﹣=2HCO3﹣+H2
查看答案和解析>>
科目: 来源: 题型:
【题目】有利于可持续发展的生态环境是全国文明城市评选的测评项目之一。
(1)已知反应 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) v 正=k 正·c2(NO)·c2(CO),v 逆=k 逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。一定条件下进行该反应,测得 CO 的平衡转化率与温度、起始投料比m=
N2(g)+2CO2(g) v 正=k 正·c2(NO)·c2(CO),v 逆=k 逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。一定条件下进行该反应,测得 CO 的平衡转化率与温度、起始投料比m=![]() 的关系如图 1 所示。
的关系如图 1 所示。

①达到平衡后,仅升高温度,k正增大的倍数________填“>”“<”或“=”)k逆增大的倍数。
②下列说法正确的是_______。
A 投料比:m1<m2<m3
B 汽车排气管中的催化剂可提高 NO 的平衡转化率
C 当投料比 m=2 时,NO 转化率比 CO 转化率小
D 当体系中 CO2 和 CO 物质的量浓度之比保持不变时,反应达到平衡状态
③若在 1L 的密闭容器中充入 1 molCO 和 1 mol NO,在一定温度下达到平衡时,CO 的转化率为 40%, 则 k 正︰k 逆=_______(填写分数即可,不用化简)
(2)在 2L 密闭容器中充入 2mol CO 和 1mol NO2,发生反应 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH<0,如图 2 为平衡时 CO2 的体积分数与温度、 压强的关系。
N2(g)+4CO2(g) ΔH<0,如图 2 为平衡时 CO2 的体积分数与温度、 压强的关系。
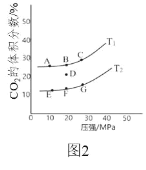
①该反应达到平衡后,为在提高反应速率同时提高 NO 的转化率,可采 取的措施有______(填字母序号)
a 增加 CO 的浓度 b 缩小容器的体积 c 改用高效催化剂 d 升高温度
②若在 D 点对反应容器降温的同时缩小体积至体系压强增大,达到的平衡状态可能是图中 A G 点中的______点。
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的 H2 可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如下图所示。若导电基体上的 Pt 颗粒增多,造成的后果是______。
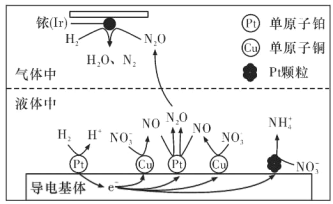
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是(已知质子交换膜的作用是只允许H+通过)( )
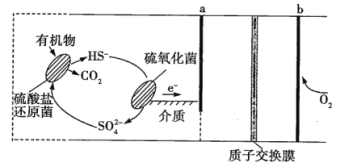
A.该电池在高温下工作的速度更快
B.HS-在硫氧化菌作用下转化为SO42-的电极反应式为HS-+4H2O-8e-=SO42-+9H+
C.b电极是电池的负极
D.该电池工作时,H+向左通过质子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】丁苯酞(J)是用于脑血管疾病治疗的药物。它的某种合成路线如下:
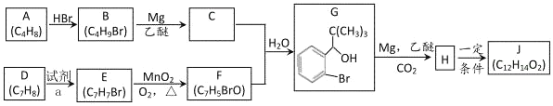
已知: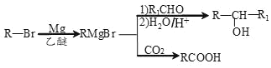
请回答下列问题:
(1)E 的名称为________,F 中所含官能团名称为_______,H→J 的反应类型为_______。
(2)B 生成 A 的方程式_______。
(3)X 是 H 的同系物,相对分子质量比 H 小 56。满足下列条件 X 的同分异构体共有_______种。
①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应。 其中核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式为_______。
(4)利用题中信息所学知识,写出以甲烷和苯甲醛为原料,合成苯乙烯的路线流程图(其他无机试 剂自选)_______。合成路线流程图表达方法例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目: 来源: 题型:
【题目】美国劳伦斯利弗莫尔国家实验室(LLNL)设计的以熔融的碳酸盐为电解质泡沫镍为电极、氧化纤维布为隔膜的直接碳燃料电池结构如图所示,下列说法错误的是( )
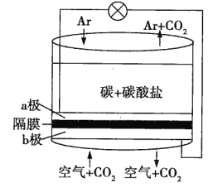
A.a极通Ar气的目的是增强导电能力
B.a极的电极反应式为C+2CO32--4e-=3CO2↑
C.电流由b极沿导线经负载再流向a极
D.CO32-由b极区透过隔膜流向a极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com