
科目: 来源: 题型:
【题目】链状有机物A是一种食用型香精,在一定条件下有如下变化:
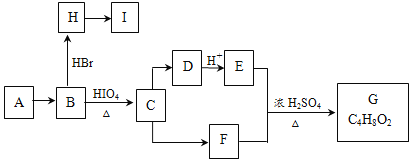
已知:(1)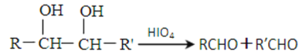
(2)A和G互为同分异构体,A不能使Br2的CCl4溶液褪色。B和F中所含官能团的类型相同。
完成下列填空:
(1)F的分子式为________________;C→D的反应类型是__________________________。
(2)A的结构简式为________________________________。
(3)若C中混有少量的E,请写出相应的除杂试剂和分离方法:________________。
(4)I中所有碳原子均在一条直线上,H转化为I的化学方程式为:______________________。
(5)X是A的一种同分异构体,1mol X在HIO4加热条件下完全反应,可以生成1mol无支链有机物,则X的结构简式为_________________。
(6)设计有1-丁烯为原料,合成H的合成路线。(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)______________________________________
目标产物)______________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)在生产中广泛用作催化剂、杀菌剂、脱色剂。某兴趣小组采用加热分解氯化铜晶体(CuCl2·xH2O)的方法制备CuCl,其装置如下(夹持仪器省略)。

已知:

完成下列填空:
(1)在实验过程中,可以观察到C中试纸的颜色变化是___________________________。
(2)实验过程中需要全程通入干燥的HCl,其作用是___________________________。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的杂质,根据已知信息
① 若杂质是CuCl2,则产生的原因可能是____________________________________。
② 若杂质是CuO,则产生的原因可能是_____________________________________。
(4)为测定原料CuCl2·xH2O中结晶水的数目x,可采取如下方案:
a.用电子天平称取一定质量氯化铜晶体 b.在______(填仪器名称)中充分灼烧
c.在干燥器中冷却 d.称量所得黑色固体质量
e.重复b ~ d操作直至_____________________
① 完成上述实验操作步骤。
② 若氯化铜晶体质量为3.384 g,最终得到黑色固体质量为1.600 g,则x =________(精确到0.1)。
③ 若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况。____________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
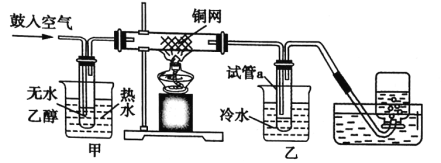
(1)实验过程中铜网出现红色和黑色交替的现象,请写出实验过程中发生反应的总化学方程式:___;在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是__(填“吸热”或“放热”)反应。
(2)甲是热水浴,乙是冷水浴,两个水浴作用不相同,甲的作用是___;乙的作用是___。
(3)反应进行一段时间后,试管a中能收集到的有机物主要有___、___。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有__。要除去该物质,可先在混合液中加入___(填写字母),然后通过蒸馏即可。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示装置检验乙烯时不需要虚线框中除杂装置的是( )
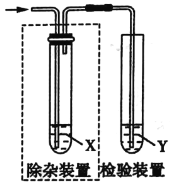
选项 | 乙烯的制备 | 试剂X | 试剂Y |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | I2的CCl4溶液 |
C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | I2的CCl4溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学—物质结构与性质】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
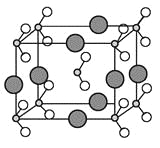
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的核外电子排布式为____________________,有___________个未成对电子。
(2)磷的一种同素异形体一一白磷(P4)的立体构型为_______________,其键角为___________,推测其在CS2中的溶解度___________(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因_________________________________。
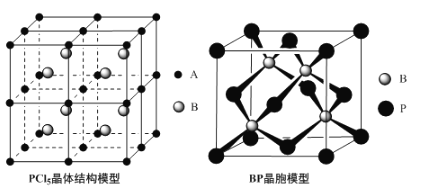
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如上左图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为___________,其中心原子杂化轨道类型为___________,B为___________。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,上图为其立方晶胞,其中的每个原子均测是8电子稳定结构,试判断其熔点___________(填“高于”或“低于”)金刚石熔点。已知其B—P键长均为xcm,则其密度为___________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:
I.某些硅酸盐具有筛选分子的功能,一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期。两元素原子的质子数之和为24。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为________________;
(2)写出M原子核外能量最高的电子的电子排布式:__________________;
(3)常温下,不能与R单质发生反应的是___________(选填序号);
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.Na2CO3溶液
(4)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式:____________________________________________。
II.氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2![]() Si3N4+CO
Si3N4+CO
(5)Si3N4晶体中只有极性共价键,则氮原子的化合价为______,被还原的元素为______________。
(6)C3N4的结构与Si3N4相似。请比较二者熔点高低。并说明理由:_____________________。
(7)配平上述反应的化学方程式,并标出电子转移的数目和方向。_________________
(8)如果上述反应在10L的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L,则制得的Si3N4质量为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、二氧化碳、青霉素、硝酸钾、乙醇、氨等“分子”改变过人类的世界。
(1)铁原子在基态时,外围电子排布式为____________。
(2)CO2的电子式为____________,1 mol CO2分子中含有σ键的物质的量为____________。
(3)6-氨基青霉烷酸的结构如图所示:
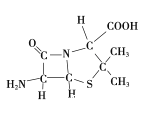
①其中C、N、O原子半径的大小关系为____________,电负性的大小关系为____________;
②其中采用sp3杂化的原子有C、____________。
(4)硝酸钾中NO3-的空间构型为____________,写出与NO3-互为等电子体的一种由前二周期元素原子构成的非极性分子化学式____________。
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是____________。
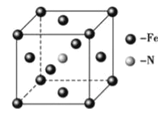
(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,若两个最近的Fe原子间的距离为a cm,则该晶体的密度计算式为____________g/cm3(用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E五种原子序数增大的元素,只有一种为金属。A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满。
(1)E元素的名称为________,该元素基态原子的价电子排布式为_______。
(2)B与D分别与氢形成最简单氢化物沸点高低顺序为____(用化学式表示);原因_____。
(3)A、B、C三种元素分别与氢形成化合物中的M-M(M代表A、B、C)单键的键能如下表:
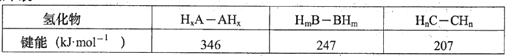
上述三种氢化物中,A、B、C元素原子的杂化方式有_____种;请解释上表中三种氢化物M-M单键的键能依次下降的原因______________________。
(4)D与氯形成的化合物DC15,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,请写出该条件下DC15电离的电离方程式__________;该熔体中阴离子的空间构型为________。
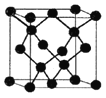
(5)E与C形成的化合物晶体结构有四种,其中一种与金刚石类似,金刚石晶体结构如图所示,该晶体的化学式为______(用元素符号表示);该晶胞的棱长为apm 则该晶体的密度为______g/cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈V 形,如图所示(图中箭头代表单键)。下列有关该物质的说法中正确的是
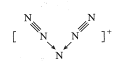
A.每个Ns+中含有35个质子和36个电子B.该离子中只含有非极性键
C.该离子中含有2个π键D.![]() 与
与![]() 互为等电子体
互为等电子体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com