
科目: 来源: 题型:
【题目】下列各项叙述中,正确的是( )
A.Na、Mg、Al的未成对电子数依次增多
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为哑铃形,能量也相等
D.氮原子的最外层电子排布图:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL 0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法不正确的是
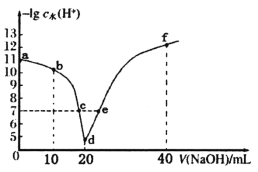
A.从a到d,HA的电离先促进再抑制
B.c、e两点溶液对应的pH=7
C.常温下,A-的水解平衡常数Kh约为1×10-9mol·L-1
D.f点的溶液呈碱性,粒子浓度之间存在:2c(HA)+c(A-)+c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列图示得出的结论不正确的是( )
A.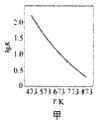 图甲是CO(g)+H2O(g)
图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0
B.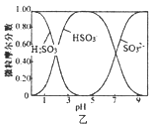 图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2
C.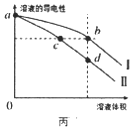 图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d
D.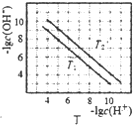 图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2
查看答案和解析>>
科目: 来源: 题型:
【题目】荧光材料硫化锌(ZnS)的研究至今已有 150 多年的历史,可用于制白色颜料、发光粉、发光油漆等,其久置于湿空气中易被氧化为 ZnSO4。请回答下列问题:
(1)基态 Zn 原子的电子排布式为_________________________,核外电子占据最高能层的符号是__________________________, 占据该能层电子的电子云轮廓图形状为__________________________。
(2)ZnSO4 中三种元素的电负性由大到小的顺序为__________________________,![]() 的立体构型为__________________________,其中 S 的杂化轨道类型为__________________________。
的立体构型为__________________________,其中 S 的杂化轨道类型为__________________________。
(3)ZnSO4 溶于氨水可生成[Zn(NH3)4]SO4 溶液,[Zn(NH3)4]SO4 溶液中不存在的微粒间作用力有__________________________。
A.离子键B.共价键C.配位键D.范德华力
(4)根据下列锌卤化物的熔点和溶解性,判断 ZnF2 晶体的类型为______;分析 ZnCl2、ZnBr2、ZnI2 熔点依次增大的原因__________________________。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中的溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
(5) 立方 ZnS 晶体的密度为 ρ g/cm3,其晶胞结构如图。

S2-周围等距离且最近的 Zn2+为__________________________;ZnS晶胞中的晶胞参数 a=__________________________nm(列出计算式)。[ M(ZnS)=97 g/mol ]
查看答案和解析>>
科目: 来源: 题型:
【题目】已知辉铜矿、软锰矿的主要成分如下表所示:
矿石 | 辉铜矿 | 软锰矿 |
主要成分 | Cu2S、Fe2O3、SiO2 | MnO2、SiO2 |
某化工厂拟以这两种矿石为原料采用湿法冶炼铜,工艺如下:
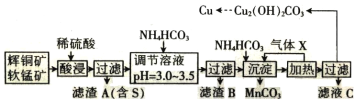
回答下列问题:
(1)气体 X 遇浓硝酸产生“白烟”,写出气体 X 的电子式:______________________________。
(2)提高“酸浸”速率的措施有______________________________(填两条)。
(3)用离子方程式表示“酸浸”中 MnO2 的作用:______________________________,被氧化的元素是______________________________(填元素符号)。
(4)已知 CH3COONH4 溶液呈中性,则常温下,NH4HCO3 溶液 pH______________________________(填“>”、“<”或“=”)7,理由是__________。
(5)从滤液 C 中可以提取一种化学肥料,它的化学式为_____________________________。
(6) 从溶液中析出的碱式碳酸铜可能带有结晶水,设其通式为 Cu2(OH)2CO3·xH2O。准确称取a g 样品,灼烧至恒重,称得 CuO 的质量,固体质量减轻 b g,则 x 为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在周期表中,锗和硅位于同主族。四氯化锗(GeCl4)是光导纤维的掺杂剂,其熔点为-49.5℃, 沸点为83.1℃;易水解,对上呼吸道及皮肤有刺激作用。实验室制备四氯化锗的原理是:Ge+2Cl2=GeCl4。某课题组同学拟选择下列装置设计实验制备四氯化锗(部分加热装置和夹持装置省略)。回答下列问题:
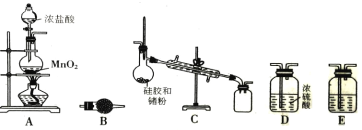
(1)写出A装置中发生反应的化学方程式_______________。
(2)若气体从左到右流动,则装置连接顺序为A、_______________。
(3)C装置中用于冷凝四氯化锗蒸气的仪器名称是_______________,B装置中的试剂是_______________。
(4)E装置中的试剂是_______________,其作用是_______________。
(5)下列有关说法正确的是_______________。
①实验中,先通入氯气,后加热C中烧瓶
②C装置中温度计的温度控制在49℃左右
③观察到D瓶有气泡和液面上有黄绿色气体
④C装置中硅胶的主要作用可能是干燥产品
(6)四氯化锗遇水蒸气产生一种强酸和一种弱酸。实验室用足量NaOH溶液吸收尾气中少量四氯化锗气体,写出该反应的化学方程式:__________________。
(7)实验中消耗m g 纯锗粉制得a g GeCl4,则锗的利用率为_______________(用含 m、a 的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】近几年来关于氮污染的治理备受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示。
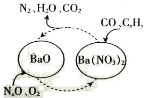
若NO、NO2的体积比为1∶1,写出氧化钡生成Ba(NO3)2的化学方程式:_______________________。从最终排放的气体来看,氮元素将_______________________(填“被氧化”或“被还原”)。
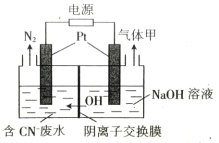
(2)用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将_______________________(填“增大”、“减小”或“不变”)。阳极的电极反应式为_______________________。
(3)汽车尾气中催化剂可将NO、CO转化成无害气体。2NO+2CO![]() N2+2CO2 ΔH
N2+2CO2 ΔH
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能(kJ/mol) | 1076 | 630 | 945 | 803 |
①ΔH=_________________kJ/mol
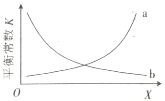
②该反应的平衡常数与外界因素X[代表温度、压强、![]() 或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
(4)在一定温度和催化剂作用下:8NH3(g)+8NO(g)+2NO2(g)![]() 9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
①n=_____________________________;
②v(NO)=_______________;
③NH3的平衡转化率为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示 25℃时,稀释 HClO、CH3COOH 两种酸的稀溶液时,溶液 pH 随加水量的变化情况。下列说法不正确的是
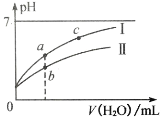
A.由图可知Ⅰ为 CH3COOH、Ⅱ为 HClO
B.图中 a 点酸溶液的浓度大于 b 点酸溶液的浓度
C.图中 a、c 两点处的溶液中![]() 相等(HR 代表 CH3COOH 或 HClO)
相等(HR 代表 CH3COOH 或 HClO)
D.相同浓度 CH3COONa 和 NaClO 的混合液中,各离子浓度的大小:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列相关描述正确的是
A.0.1 mol/L 的(NH4) 2SO4 溶液:c(![]() )>c(
)>c(![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
B.0.1 mol/L 的 NaHCO3溶液:c(H+)+c(Na+)=c(OH-)+c(![]() )+2c(
)+2c(![]() )
)
C.常温下恰好中和等体积、相同 pH 的氨水和 NaOH 溶液,消耗盐酸的量相同
D.常温下醋酸钠和醋酸的混合溶液 pH=7,则 c(Na+)>c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com