
科目: 来源: 题型:
【题目】溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢被氧化。实验室制备![]() 的步骤如下:
的步骤如下:
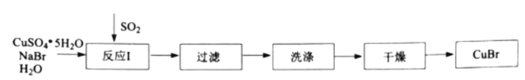
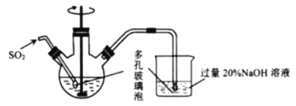
(1)反应Ⅰ在如图所示实验装置的三颈烧瓶中进行,实验所用蒸馏水需经煮沸,目的是除去水中的_________(写化学式)。
(2)反应Ⅰ中:三颈烧瓶中反应生成![]() 的离子方程式为________;烧杯中发生反应的化学方程式为________。
的离子方程式为________;烧杯中发生反应的化学方程式为________。
(3)过滤步骤中,需要在避光的条件下进行,原因是________。
(4)洗涤步骤中,依次用溶有少量![]() 的水、溶有少量
的水、溶有少量![]() 的乙醇、纯乙醚洗涤。洗涤剂需“溶有
的乙醇、纯乙醚洗涤。洗涤剂需“溶有![]() ”的原因是________。
”的原因是________。
(5)欲利用上述装置烧杯中的吸收液制取较纯净的无水![]() 晶体。
晶体。
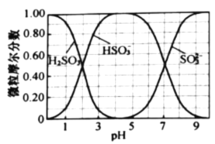
(水溶液中![]() 、
、![]() 、
、![]() 随
随![]() 的分布,
的分布,![]() 的溶解度曲线如题图所示)。
的溶解度曲线如题图所示)。
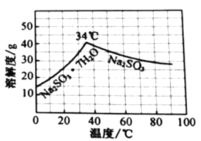
请补充完整实验方案[须用到![]() (贮存在钢瓶中)、
(贮存在钢瓶中)、![]() 计]:
计]:
①________;
②加入少量维生素C溶液(抗氧剂),加热浓缩溶液至有大量晶体析出;
③________;
④用无水乙醇洗涤2-3次;
⑤放真空干燥箱中干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室模拟用![]() 溶液和
溶液和![]() 溶液混合制备
溶液混合制备![]() ,再将所得
,再将所得![]() 与
与![]() 溶液混合,可制备草酸合铜酸钾晶体
溶液混合,可制备草酸合铜酸钾晶体![]() 。通过下述实验确定该晶体的组成。
。通过下述实验确定该晶体的组成。
步骤Ⅰ 称取![]() 样品,放入锥形瓶,加入适量
样品,放入锥形瓶,加入适量![]() 稀硫酸,微热使样品溶解,再加入
稀硫酸,微热使样品溶解,再加入![]() 水加热,用
水加热,用![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液。
溶液。
步骤Ⅱ 将步骤Ⅰ的溶液充分加热,使淡紫红色消失,溶液最终显示蓝色。冷却后,调节![]() 并加入过量
并加入过量![]() 固体,与
固体,与![]() 反应生成
反应生成![]() 沉淀和
沉淀和![]() ,以淀粉作指示剂,用
,以淀粉作指示剂,用![]() 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗![]() 标准溶液。
标准溶液。
已知:![]() ;
;
![]() ;
;![]()
回答下列问题:
(1)室温下,![]() ,
,![]() ,
,![]() 溶液
溶液![]() ________7(填“>”或“<”或“=”)。
________7(填“>”或“<”或“=”)。
(2)步骤Ⅱ中滴定终点的现象为________。
(3)步骤Ⅱ中若消耗的![]() 标准溶液的体积偏大,可能的原因有________(填字母)。
标准溶液的体积偏大,可能的原因有________(填字母)。
A.滴定前未将待测溶液充分加热
B.锥形瓶水洗后未干燥
C.装![]() 标准溶液的滴定管水洗后未润洗
标准溶液的滴定管水洗后未润洗
D.滴定时锥形瓶中有液体溅出
(4)通过计算确定该晶体的化学式(写出计算过程)。
________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(![]() )是复合型的水处理剂,以废铁屑(含有
)是复合型的水处理剂,以废铁屑(含有![]() 、
、![]() 、油污等杂质)为原料制备的流程如下:
、油污等杂质)为原料制备的流程如下:
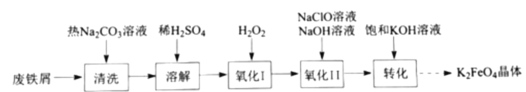
(1)热的![]() 溶液清洗废铁屑的目的是_________。
溶液清洗废铁屑的目的是_________。
(2)氧化Ⅰ中![]() 被氧化成
被氧化成![]() 的离子方程式为________。
的离子方程式为________。
(3)![]() 溶液在不同
溶液在不同![]() 下,
下,![]() 的浓度随时间的变化如图所示。氧化Ⅱ制备
的浓度随时间的变化如图所示。氧化Ⅱ制备![]() 时,选用的加料方式是_________(填字母),原因是________。
时,选用的加料方式是_________(填字母),原因是________。

A. 将![]() 、
、![]() 混合液与氧化Ⅰ所得溶液同时加入到反应容器中
混合液与氧化Ⅰ所得溶液同时加入到反应容器中
B. 将![]() 、
、![]() 混合液缓慢加入到盛有氧化Ⅰ所得溶液的反应容器中
混合液缓慢加入到盛有氧化Ⅰ所得溶液的反应容器中
C. 将氧化Ⅰ所得溶液缓慢加入到盛有![]() 、
、![]() 混合液的反应容器中
混合液的反应容器中
(4)转化步骤中加入饱和![]() 溶液,析出
溶液,析出![]() 晶体的原因是________。
晶体的原因是________。
(5)高铁酸钾是高效复合型的水处理剂的原因:①高铁酸钾有强氧化性,可以用于杀菌消毒;②________。
(6)高铁酸钾可用于高铁电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为![]() ,放电时正极的电极反应式为________。
,放电时正极的电极反应式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在3个体积均为2.0L的恒容密闭容器中,反应CO2(g)+C(s)![]() 2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
Ⅰ | 977 | 0.28 | 0.56 | 0 | 0.4 |
Ⅱ | 977 | 0.56 | 0.56 | 0 | x |
Ⅲ | 1250 | 0 | 0 | 0.56 | y |
A.达到平衡时,向容器Ⅰ中增加C(s)的量,平衡正向移动
B.x=0.8,y>0.4
C.达到平衡时,容器Ⅲ中的CO的转化率小于![]()
D.若起始时向容器Ⅱ中充入0.1molCO2、0.2molCO和足量的C(s),则反应将向正反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.2mol/LNH4HCO3溶液(pH>7):c(![]() )>c(
)>c(![]() ),c(H2CO3)>c(NH3H2O)
),c(H2CO3)>c(NH3H2O)
B.0.2mol/L氨水:0.2mol/L>c(OH-)+ c(NH3H2O)
C.向0.1mol/LNH4HCO3溶液中通入CO2至溶液pH=7:c(![]() )=c(
)=c(![]() )+c(
)+c(![]() )
)
D.pH=2的盐酸与pH=12的氨水等体积混合:c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据《化学反应原理》中相关知识,按要求作答。
氯的单质、化合物与人类生产、生活和科研密切相关。
(1)在一定条件下,氢气在氯气中燃烧的热化学方程式: H2(g)+Cl2(g)=2HCl(g)△H = -184.6 kJ . mol-1,判断该反应属于_____(填“吸热”或“放热")反应。
(2)盐酸是一种强酸,补充完整电离方程式:HCl=___+Cl- 。室温下,将大小相等的镁条和铁片投入同浓度的稀盐酸中,产生氢气的速率较大的是________。
(3)84消毒液在防控新冠肺炎疫情中被大量使用,它是利用氯气与氢氧化钠溶液反应制成的.反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
①该反应____(填“是”或“不是”)氧化还原反应。
②室温下,84消毒液呈碱性,其pH___7 (填“>”或“<”)。
③84消毒液的有效成分NaClO,水解的离子方程式:ClO-+H2O=HClO+OH-,生成物中__具有很强的氧化性,可以使病毒和细菌失去生理活性;水解是吸热反应,升高温度平衡向_____(填“正反应”或“逆反应”)方向移动。
(4)电解熔融氯化钠可制取金属钠和氯气,装置如图所示(电极不参与反应):
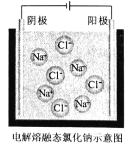
通电时,Na+向______(填“阳极”或“阴极")移动,写出生成金属钠的电极反应式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为制取NH3并探究其性质,按下图装置进行实验。(制取氨气的反应原理:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3+2H2O,部分夹持仪器已略去)
CaCl2+2NH3+2H2O,部分夹持仪器已略去)
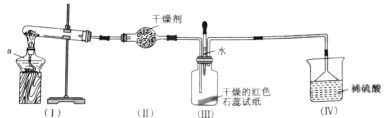
(实验探究)(1)装置(I)中仪器a的名称是_____。
(2)装置(Ⅱ)中可用_________(填“碱石灰”或“食盐”)作干燥剂。
(3)实验进行一段时间后,装置(Ⅲ)中干燥的红色石蕊试纸不变色,然后滴加水,观察到试纸颜色变为___(填“白色”或“蓝色”)原因是氨水呈____(填“碱性”或“酸性”)。
(4)装置(Ⅲ)中胶头滴管若改装浓盐酸,实验进行一段时间后,滴加浓盐酸,观察到瓶内充满_______(填“白烟”或“白雾”),写出NH3与HCl反应生成NH4Cl的化学方程式:_________。
(5)装置(IV)中稀硫酸的作用是___________。
(6)用0.1 mol NH4Cl与足量Ca(OH)2反应,理论上可生成NH3的物质的量是____mol。
(实验拓展)(7)已知:2NH3+3CuO![]() 3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为____(填“白色”或“红色”),在这过程中NH3表现出__(填“还原性”或“氧化性”)。
3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为____(填“白色”或“红色”),在这过程中NH3表现出__(填“还原性”或“氧化性”)。
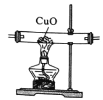
(知识应用)(8)氨气是一种重要的化工原料。写出它的一种用途:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如下:
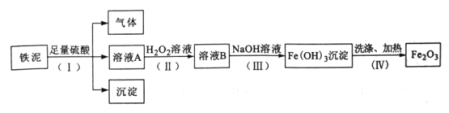
(1)步骤(I)中生成的气体是_____,溶液A和沉淀分离的操作名称是_______。
(2)步骤(Ⅱ)中加入H2O2溶液后,Fe2+被____(填“氧化”或“还原")成Fe3+。
(3)步骤(Ⅲ)中生成Fe(OH)3沉淀的颜色是_______(填“白色”或“红褐色")。
(4)步骤(IV)中Fe(OH)3受热分解生成Fe2O3和H2O的化学方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,按要求作答
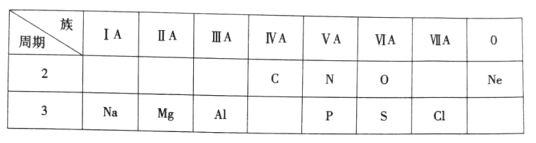
(1)镁元素位于元素周期表中第___周期_____族;
(2)空气组成中体积分数最大的气体是_____;
(3)O与S相比,原子半径较小的是____;
(4)金刚石的组成元素是________;
(5)单质的化学性质最不活泼的元素是______;
(6)Na与Mg元素相比金属性较强的是_________
(7)NH3与PH3相比,热稳定性较弱的是______
(8)H2SO4与H3PO4相比酸性较强的是______
(9)Mg(OH)2与Al(OH)3其中属于两性氢氧化物的是________
(10)单质呈黄绿色的气体组成元素是_____,其单质的水溶液呈__(填“酸性或“碱性”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.反应![]() 在室温下可自发进行,则该反应的
在室温下可自发进行,则该反应的![]()
B.![]() 溶液加水稀释后,溶液中
溶液加水稀释后,溶液中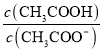 的值减小
的值减小
C.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
D.![]() 溶液中加入少量
溶液中加入少量![]() 固体,
固体,![]() 的水解程度减小,溶液的
的水解程度减小,溶液的![]() 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com