
科目: 来源: 题型:
【题目】下列化学用语书写正确的是( )
A.金属发生电化学腐蚀的正极反应式:M-ne-=Mn+
B.家用小苏打溶于水后的电离:NaHCO3=Na++H++CO![]()
C.氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O=Fe(OH)3↓+H+
D.用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4(s)+CO![]() (aq)CaCO3(s)+SO
(aq)CaCO3(s)+SO![]() (aq)
(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】3,4-二羟基肉桂酸乙酯(I)具有抗炎作用和治疗自身免疫性疾病的潜力。由化合物A制备该物质的合成路线如下:
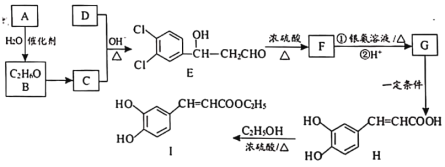
已知:R—CHO+R′—CH2—CHO![]()
![]()
回答下列问题:
(1)A的结构简式为___________。
(2)E生成F的反应类型为___________。
(3)下列有关H的说法中,不正确的是___________。
a.能使酸性高锰酸钾溶液褪色
b.1 mol H最多能和3 mol Br2反应
c.H分子中最多有9个碳原子共平面
d.l mol H分别与足量NaOH、NaHCO3反应时,消耗的NaOH、NaHCO3的物质的量之比为1:1
(4)写出C+D→E的化学方程式__________。
(5)已知W是H的同分异构体,符合下列条件的W结构共有________种。
①属于芳香族化合物。
②1 mol W与足量NaHCO3溶液反应生成气体44.8 L(标准状况)。其中,核磁共振氢谱有4组吸收峰,且峰面积比为1:2:2:3的结构简式为:_________。
(6)季戊四醇(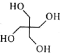 )是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A
)是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列问题:
(1)研究发现,在CO2低压合成甲醇反应(CO2+3H2 === CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
Co基态原子核外电子排布式为________,元素Mn与O中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是________。
(2)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。
回答下列问题:
①氮原子的价电子排布图为_________。
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是________;氮元素的E1呈现异常的原因是_______。
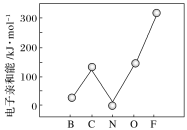
查看答案和解析>>
科目: 来源: 题型:
【题目】大气中NOx、SO2等污染物的有效去除和资源的充分利用是当今社会的重要研究课题,目前采用的方法如下:
I.直接转化法:利用高效催化剂将汽车尾气直接转化为无毒物质。
已知:N2(g)+O2(g)=2NO(g)△H1=+180kJ·mol-1
(1)利用固体表面催化工艺将NO分解为N2、O2而消除污染。
用![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是________________________(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是________________________(填字母序号)。
![]()
(2)利用稀土等催化剂能将汽车尾气中的CO、NO直接转化成无毒物质N2、CO2。
①已知:C(s)、CO(g)的燃烧热分别为393kJ·mol-1、283kJ·mol-1,写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式________________________。
②为研究上述反应,某学习小组在密闭容器中充入10molCO和10molNO,发生上述①所写反应,实验测得平衡时NO的体积分数随温度、压强的关系如图。

a.某温度下的平衡状态D点,若同时采取缩小容器体积和降低温度,重新达到平衡状态时,可能到达图中A~G点中的________________________点。
b.当压强为10MPa、温度为T时的平衡常数Kp=________________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留3位有效数字)。
II.催化还原法:利用还原剂在催化剂的作用下将氮氧化物转为无毒物质N2、CO2。
(3)用活性炭还原法可以处理汽车尾气中的氮氧化物。
某研究小组在2L的恒容密闭容器中加入一定量的NO和足量的固体活性炭,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表:
N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表:
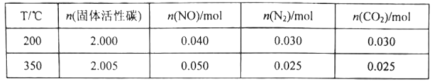
①该反应的正反应为________________________(填“吸热”或“放热”)反应。
②350℃时,反应达到平衡后向恒容容器中再充入0.100molNO,再次达到平衡后,N2的体积分数应为________________________。
A.0.5B.0.25C.介于0.25和0.5之间D.无法确定
III.电解法:利用电解的方法将氨氧化物转化为有用物质,从而达到资源的回收利用。
(4)如图所示的电解装置,可将雾霾中的NO2、SO2转化为硫酸铵,从而实现废气的回收再利用,回答下列问题:
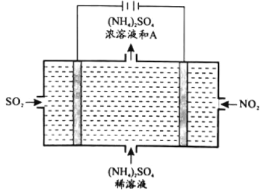
①阴极的电极反应式为________________________。
②上图中A物质是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】新冠疫情期间使用大量的消毒剂,其中二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如下装置由二氧化氯制备NaClO2·3H2O,并探究其性质。
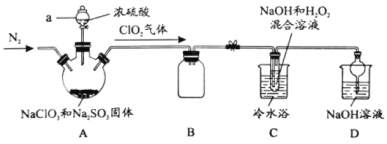
查阅资料:
①ClO2易与碱反应生成亚氯酸盐和氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
回答下列问题:
(1)仪器a的名称_________。
(2)装置A中发生反应的化学方程式:________。
(3)如果撤去C装置中的冷水浴,导致产品中可能混有的杂质是_______。
(4)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤③的内容。
①减压,55℃蒸发结晶; ②趁热过滤;③_________; ④低于60℃干燥,得到成品。
(5)写出装置C反应的离子方程式________。
(6)实验结束后,继续通入一段时间N2的目的是________。
(7)利用题中原理制备出NaClO2·3H2O晶体的试样,可以用“间接碘量法”测定试样(杂质与I-不发生反应)的纯度,过程如下:(已知:I2+2![]() =
=![]() +2I-)取样品0.6000 g配制成250 mL溶液,从中取出25.0 mL加入足量KI固体和适量稀硫酸,再滴加几滴淀粉溶液,然后用0.0600 mol/L Na2S2O3标准溶液滴定,当出现________(填实验现象),达到滴定终点,共消耗该标准溶液25.00 mL,经计算该试样中NaClO2·3H2O的百分含量为______(结果保留3位有效数字)。
+2I-)取样品0.6000 g配制成250 mL溶液,从中取出25.0 mL加入足量KI固体和适量稀硫酸,再滴加几滴淀粉溶液,然后用0.0600 mol/L Na2S2O3标准溶液滴定,当出现________(填实验现象),达到滴定终点,共消耗该标准溶液25.00 mL,经计算该试样中NaClO2·3H2O的百分含量为______(结果保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】六氟磷酸钠(NaPF6)极易溶于水,可溶于乙醇、丙酮等有机溶剂,可作高能钠电池的电解质。工业上以氟磷灰石[Ca5(PO4)3F]、NaCl为主要原料,制备六氟磷酸钠的工艺流程如下:
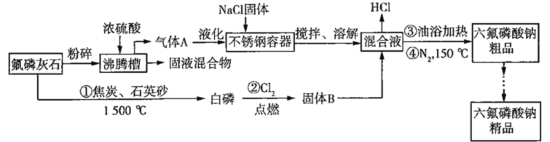
已知:HF的熔点为-83 ℃,沸点为19.5 ℃。回答下列问题:
(1)氟磷灰石粉碎的目的是_______________。
(2)HF液化时产生的二聚物(HF)2能发生微弱的电离,与NaCl反应生成NaHF2,请写出该二聚物的电离方程式:________。
(3)为避免废水NaH2PO4的污染,常在其中加入石灰,将磷元素全部转化成磷酸钙,进行回收利用。已知常温下Ksp[Ca3(PO4)2]=1.96×10-29,当处理后的废水c(Ca2+)=1.0×10-5 mol/L时,则溶液中c(![]() )=___________mol/L。
)=___________mol/L。
(4)操作③油浴加热目的是________。
(5)反应①中除生成白磷(P4)外,还产生SiF4和一种还原性气体,写出该反应的化学方程式:______。
(6)六氟磷酸钠粗品的提纯:将六氟磷酸钠粗品(杂质主要是微量铁盐)溶于一定量乙醇中,加入适量5%的NaOH甲醇溶液,使溶液保持碱性,离心将不溶杂质除去。通过______(填操作方法)将溶剂回收,减压条件下结晶,得到NaPF6·H2O,干燥得到无水盐。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用![]() 和
和![]() 制备
制备![]() 的原理为:
的原理为:
①![]()
②![]()
已知:A、B均为有机物,两个反应均能自发进行;NA代表阿伏加德罗常数。下列说法正确的是
A.B为![]() 和
和![]() 制备
制备![]() 的催化剂
的催化剂
B.1mol![]() 与足量的B在一定条件下发生反应②,共转移2NA个电子
与足量的B在一定条件下发生反应②,共转移2NA个电子
C.反应①的反应物的总能量大于产物的总能量
D.标准状况下,22.4L![]() 含NA个分子
含NA个分子
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向0.1L0.1mol·L-1CH3COOH溶液中逐渐加入NaOH固体,恢复至原温度后溶液中离子浓度关系如下图所示(忽略溶液体积变化)。下列有关叙述正确的是

A.25℃,CH3COOH的Ka数量级为10-4
B.B点:加入的NaOH的物质的量为0.005mol
C.A点:c(CH3COO-)+c(OH-)+c(CH3COOH)-c(H+)>0.1mol·L-1
D.A到C的过程中不考虑温度变化: 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】格列本脲是一种降糖及利尿的药物,一种合成格列本脲的路线如图:
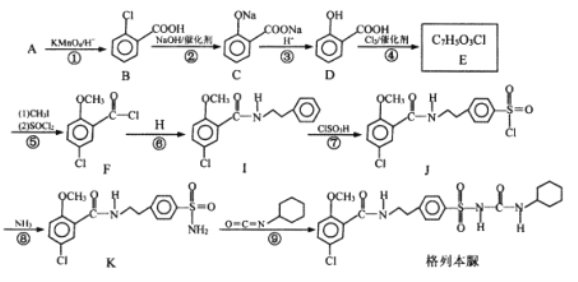
已知:(1)![]() (2)
(2)![]()
回答下列问题:
(1)B含有的官能团名称是_______,D的名称是__________。
(2)H的结构简式为__________。
(3)写出下列反应的反应类型:⑥__________,⑨__________。
(4)写出E与CH3I反应的化学反应方程式__________。
(5)符合下列要求的E的同分异构体有__________种。
①具有酯基、能发生银镜反应 ②遇FeCl3溶液显紫色
(6)以甲苯和![]() 为原料,其他无机试剂自选,参照上述格列本脲的合成路线,设计一条制备甲磺丁脲(
为原料,其他无机试剂自选,参照上述格列本脲的合成路线,设计一条制备甲磺丁脲(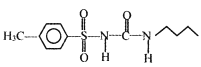 )的合成路线_____________.
)的合成路线_____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu—Mn—Al合金为磁性形状记忆合金材料之一,可用来制作各种新型的换能器、驱动器、敏感元件和微电子机械操纵系统。
(1)下列状态的铝中,最外层电离出一个电子所需能量最小的是______(填标号)。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)AlCl3是某些有机反应的催化剂,如苯与乙酰氯反应的部分历程为:

①乙酰氯分子中碳原子的杂化类型为____。
②乙酰氯分子中∠CCCl___120°(填“>”、“=”或“<”),判断理由是_______。
③![]() 的空间构型为________。
的空间构型为________。
(3)温度不高时气态氯化铝为二聚分子(其结构如图所示)。

写出Al2Cl6的结构式并标出配位键______。
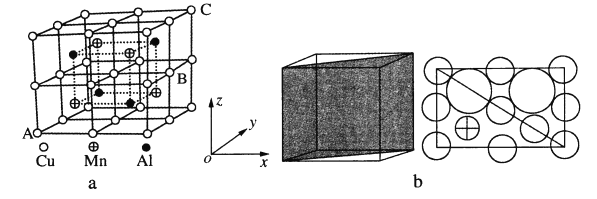
(4)Cu—Mn—合金的晶胞如图a所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图。
①若A原子的坐标参数为(0,0,0),C为(1,1,1),则B原子的坐标参数为_____。
②由晶胞可知该合金的化学式为_____。
③已知r(Cu)≈r(Mn)=127pm,r(Al)=143pm,则Cu原子之间的最短核间距离为____pm。
④该晶胞的密度为_____g·cm-3。(列出计算式即可,阿伏加德罗常数用NA表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com