
科目: 来源: 题型:
【题目】氮的化合物应用广泛,但其对环境造成污染进行治理已成为环境科学的重要课题。请回答下列问题:
(1)在汽车的排气管上加装催化转化装置可减少NOx的排放。研究表明,NOx的脱除率除与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以![]() (A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:![]() (不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:![]()
![]()
![]()
……
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是_________________。第二阶段中各反应关系在该温度下,NO脱除反应![]() 的平衡常数_________________ (用
的平衡常数_________________ (用![]() 的表达式表示)。
的表达式表示)。
(2)为研究汽车尾气转化为无毒无害的物质有关反应,在密闭容器中充入10molCO和8molNO,发生反应![]() ,如图为平衡时的体积分数与温度、压强的关系。
,如图为平衡时的体积分数与温度、压强的关系。
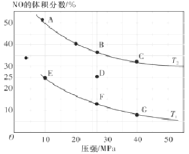
①该反应达到平衡后,为在提高反应速率同时提高NO的转化率,可采取的措施有_________________(填字母序号)
a.改用高效催化剂b.缩小容器的体积c.升高温度d.增加CO的浓度
②压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,容器的体积为4L,用CO2的浓度变化表示的平均反应速率![]() _________________,该温度下平衡常数Kp=_________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留两位有效数字)。
_________________,该温度下平衡常数Kp=_________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留两位有效数字)。
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(![]() ),其工作原理如图所示
),其工作原理如图所示
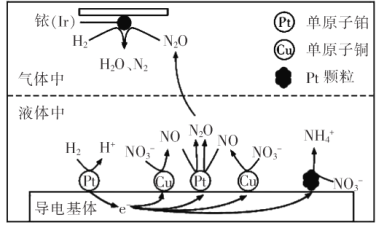
①Ir表面发生反应的方程式为_________________;若导电基体上的Pt颗粒增多,造成的后果是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A的结构简式是![]() ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
B.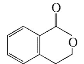 C.
C.![]() D.
D.![]() 。
。
(1)有机物A分别与足量的Na、NaOH、NaHCO3反应时,消耗三者物质的量之比为___。
(2)写出B的分子式___。
(3)写出由A制取C的化学方程式___,反应类型___。
(4)由D也可以制取C,写出有关反应的方程式___。
(5)具备以下条件A的同分异构体有___种。
①能水解且能发生银镜反应
②遇三氯化铁溶液显色
③苯环上有三个取代基
查看答案和解析>>
科目: 来源: 题型:
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取![]() 的工艺流程如下:
的工艺流程如下:
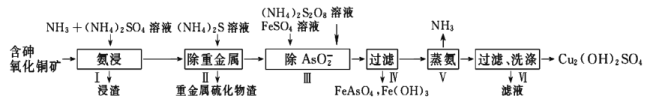
(1)过程中可循环利用物质的电子式是_________________。
(2)步骤I“氨浸”时,控制温度为5055℃,pH约为9.5,含铜化合物转化为![]() 溶液。
溶液。
①CuO被浸取的离子方程式为_________________。
②浸取温度不宜超过55℃,其原因是_________________。
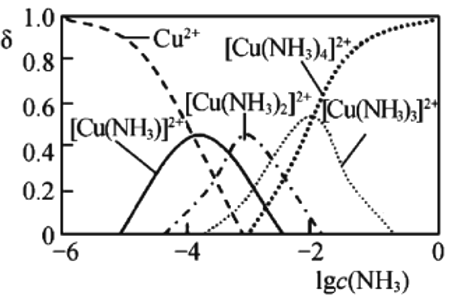
③Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(![]() )与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amol
)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amol![]() 全部浸出为
全部浸出为![]() (
(![]() 转变为
转变为![]() ,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是_________________。
,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是_________________。
(3)“除![]() ”时,加入的试剂是
”时,加入的试剂是![]() 和
和![]() 。
。
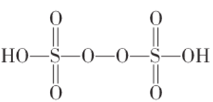
①已知![]() 结构式如图,根据此结构确定
结构式如图,根据此结构确定![]() 中S元素的化合价为_________________。
中S元素的化合价为_________________。
②![]() 需过量,一方面使
需过量,一方面使![]() 沉淀完全,另一目的是_________________。
沉淀完全,另一目的是_________________。
(4)“蒸氨”时发生反应的化学方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸丁酯的物理性质如表。
乙酸 | 1-丁醇 | 乙酸丁酯 | |
熔点(℃) | 16.6 | -89.5 | -73.5 |
沸点(℃) | 117.9 | 117 | 126.3 |
密度(g/cm3) | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
实验室用如图所示的实验装置制取乙酸丁酯。
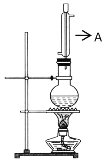
(1)仪器A的名称___。
(2)写出制取乙酸丁酯的化学方程式:__。
(3)该实验中生成物除了主产物乙酸丁酯外,还可能生成的有机副产物有__(写出一种结构简式)。
(4)酯化反应是一个可逆反应,为提高1-丁醇的转化率,可采取的措施是__(写出两条)。
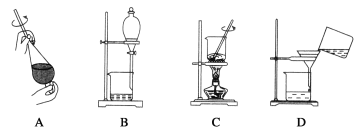
(5)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,需要的是__(填答案编号)。
(6)用60g乙酸与37g1-丁醇反应,实验中得到乙酸丁酯的质量为40.6g,则乙酸丁酯的产率为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)写出基态Fe2+的核外电子排布式__。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有__和__。1molK4[Fe(CN)6]含有σ键为__mol。
(3)黄血盐中N原子的杂化方式为__;C、N、O的第一电离能由大到小的排序为__,电负性由大到小的排序为__。
(4)Fe、Na、K的晶体结构如图所示:
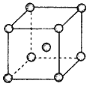
①钠的熔点比钾更高,原因是__。
②Fe原子半径是rcm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是__g/cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有下列三种有机物:
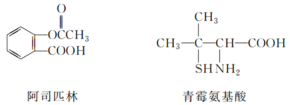
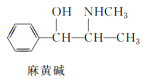
下列叙述不正确的是( )
A.三种有机物都能发生取代反应
B.1mol阿司匹林最多能与3molNaOH反应
C.麻黄碱属于芳香烃,苯环上的一氯代物有3种
D.青霉氨基酸既能与盐酸反应,又能与NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验室废液含![]() 等离子,现通过如下流程变废为宝制备
等离子,现通过如下流程变废为宝制备![]() 。
。
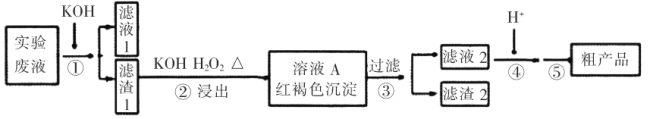
已知:(a)![]()
![]() (黄色)
(黄色)
(b)金属离子形成氢氧化物沉淀的pH范围如表。
金属离子 | pH | |
沉淀 | 沉淀 | |
Fe3+ | 2.7 | 3.7 |
Cr3+ | 4.9 | 6.8 |
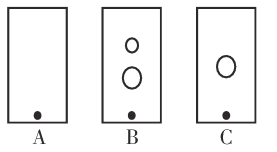
请回答:
(1)如在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是:_________________。
(2)某同学采用纸层析法判断步骤①加入KOH的量是否合适。在加入一定量KOH溶液后,用毛细管取样、点样、薄层色谱展开、氨熏后的点如图所示。加入KOH最适合的实验编号是(上图ABC中选择,实验顺序已乱)_________________,C的斑点颜色为_________________。
(3)步骤②含Cr物质发生的主要反应的离子方程式为_________________。
(4)在下列装置中,步骤②应选用实验装置是_________________。(填标号)
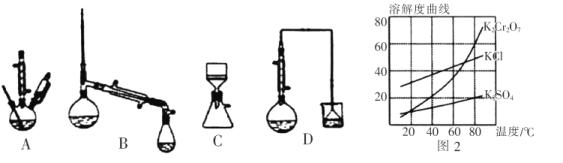
(5)部分物质的溶解度曲线如图2,步骤⑤可能用到下列部分操作:a.蒸发至出现大量晶体,停止加热;b.冷却至室温;c.蒸发至溶液出现晶膜,停止加热;d.洗涤;e.趁热过滤;f.抽滤。请选择合适操作的正确顺序_________________。
(6)步骤⑤中合适的洗涤剂是_________________(“无水乙醇”、“乙醇-水混合液”、“热水”、“冰水”),粗产品进一步提纯的方法是_________________。
(7)取mg粗产品配成250mL溶液,取25.00mL于锥形瓶中,用cmol.L-1的![]() 标准溶液滴定(杂质不反应),消耗标准
标准溶液滴定(杂质不反应),消耗标准![]() 溶液VmL,则该粗产品中
溶液VmL,则该粗产品中![]() 的纯度为_________________。(
的纯度为_________________。(![]() 的式量:294)
的式量:294)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某兴奋剂乙基雌烯醇的结构如图所示。下列叙述正确的是( )

A.该物质可以视为酚类
B.能使溴的四氯化碳溶液褪色
C.该物质分子中的所有碳原子均共面
D.在浓硫酸作用下,分子内消去一个水分子,产物有三种同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖B. 可采取分液的方法分离乙醇和水
C. 可用碘水检验淀粉是否完全水解D. 葡萄糖可以在酒曲酶作用下分解生成乙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中对生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=﹣lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com