
科目: 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价,如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是
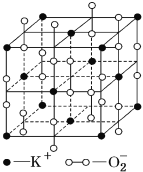
A. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个![]()
B. 晶体中每个K+周围有8个![]() ,每个
,每个![]() 周围有8个K+
周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个,晶体中与每个![]() 距离最近的
距离最近的![]() 有6个
有6个
D. 晶体中其中0价氧和-2价氧的物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】分别调节0.01mol·L-1HCOOH溶液、0.01mol·L-1氨水的pH,系统中微粒浓度的负对数值(-lgc)与pH的关系分别如下图所
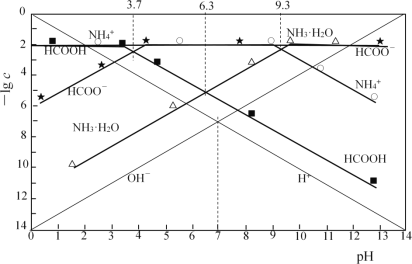
下列说法错误的是
A. 25℃时,NH3·H2O![]() NH4++OH-的lgK=-4.7
NH4++OH-的lgK=-4.7
B. 25℃时,0.01mol·L-1HCOOH溶液的pH为3.7
C. HCOONa溶液中加入NH4Cl至溶液呈中性:c(Cl-)>c(Na+)>c(HCOO-)
D. HCOONa溶液中加入KHSO3至溶液呈中性:c(HCOOH) +c(H2SO3) = c(SO32-)
查看答案和解析>>
科目: 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是

A. 电池工作时,负极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池充电时间越长,电池中的Li2S2量越多
C. 电解质中加入硫酸能增强导电性
D. 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
查看答案和解析>>
科目: 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值。下列说法错误的是
表示阿伏加德罗常数的值。下列说法错误的是
A.![]() 与
与![]() 组成的混合物中,含有的电子数目为
组成的混合物中,含有的电子数目为![]()
B.![]() (标准状况)
(标准状况)![]() 与足量乙烷反应时,断裂的
与足量乙烷反应时,断裂的![]() 键数目为
键数目为![]()
C.![]() 浓度均为
浓度均为![]() 的
的![]() 、
、![]() 溶液中,
溶液中,![]() 数目前者比后者多
数目前者比后者多![]()
D.![]() [电离方程式:
[电离方程式:![]() ]消耗
]消耗![]() 数目最多为
数目最多为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于价电子排布式为3s23p4的粒子的描述正确的是( )
A. 它的原子核外有三种形状不同的电子云
B. 它的原子核外电子共有16种不同的运动状态
C. 它可与H2反应生成常温时的液态化合物
D. 该原子的轨道表示式为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示的装置中,A是氯气发生仪器,C、D为气体净化装置(C中装有饱和食盐水,D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G中装有氢氧化钠溶液。
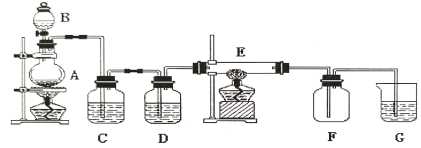
请回答下列问题:
(1)仪器A的名称是_________;B中盛装的药品是_____________;
(2)将实验室制氯气的化学方程式补充完整:MnO2+4HCl(浓)![]() ________ + Cl2↑+ 2H2O;
________ + Cl2↑+ 2H2O;
(3)C装置的作用是____________;D装置的作用是____________;
(4)E中发生化学反应的方程式为__________________;
(5)烧杯G中氢氧化钠溶液的作用是_______________;其发生反应的化学方程式为:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有4种物质:碳酸氢钠、硫酸钡、烧碱、苯。(以下必须填写化学式)
(1)属于碱的是________________;
(2)属于硫酸盐的是________________;
(3)属于酸式盐的是________________;
(4)属于有机物的是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表列出了5种元素在周期表中的位置。
| ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ |
(1)①的元素符号是________,⑤的原结构示意图是________________;
(2)以上元素中,金属性最强的是________________(填元素符号);
(3)④元素的最高价氧化物对应的水化物呈________性(填“酸”或“碱”或“两”);
(4)③④⑤三种元素按原子半径由大到小的顺序是__________(填元素符号);
(5)元素③与元素⑤形成的化合物的名称是________________;
(6)少量元素③的单质通常保存在________中(填“煤油”或“水”);
(7)元素①与元素②的单质氧化性较强的是________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
B.铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C.碳酸钙与稀盐酸反应:CO![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
D.硫酸钠溶液和氯化钡溶液反应:Ba2++SO![]() =BaSO4↓
=BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能被视为最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。请回答下列问题:
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
(1)基态B原子的价电子排布式为_____,B、C、N、O第一电离能由大到小的顺序为_____,CH4、NH3、CO2的键角按照由大到小的顺序排列为_____。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图),每个杂环平面上下两侧最多可吸附10个H2分子。
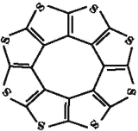
①S的基态原子中能量最高的电子,其原子轨道呈_____形。
②C16S8与H2微粒间的作用力是_____。
③C16S8分子中C原子和S原子的杂化轨道类型分别为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com