
科目: 来源: 题型:
【题目】按要求写出下列方程式
(1)铝热反应冶炼金属铁的化学方程式:___。
(2)工业冶炼金属铝的化学方程式:___。
(3)铝片打磨后与氢氧化钠溶液反应的离子方程式:___。
(4)四氧化三铁与稀硝酸反应的离子方程式:___。
(5)向NH4Al(SO4)2溶液中滴加氢氧化钡溶液使SO![]() 恰好完全沉淀,写出反应的离子方程式:___。
恰好完全沉淀,写出反应的离子方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体粉末X中可能含有K2SO4、(NH4)2CO3、K2SO3、NaNO3、Cu2O、FeO、Fe2O3中的若干种。某同学为确定该固体粉末的成分,取X进行如下实验,实验过程及现象如图所示。该同学得出的结论不正确的是( )

已知:Cu2O+2H+=Cu2++Cu+H2O
A.根据现象1无法推出固体粉末中是否含有NaNO3
B.根据现象2可推出白色沉淀是BaSO4
C.根据现象3可推出固体粉末中一定含有K2SO3
D.根据现象4可推出固体粉末中的氧化物只有FeO
查看答案和解析>>
科目: 来源: 题型:
【题目】下列操作对应的现象和离子方程式均正确的是( )
操作 | 现象 | 离子方程式 | |
A | 饱和碳酸钠溶液中通入过量CO2 | 无明显变化 | CO |
B | 向苏打溶液溶液中滴加稀硫酸 | 立即产生气泡 | CO |
C | 向Ba(OH)2溶液中加足量NaHCO3溶液 | 生成白色沉淀 | 2HCO |
D | 向NaHCO3溶液中加入少量偏铝酸钠 | 生成白色沉淀和无色气体 | HCO |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不正确的是( )
A.24g镁与27g铝中,质子数之比为12∶13
B.相同质量的16O2和18O2,体积比为9∶8
C.将1LCmol·L-1氯化钠溶液加入水中稀释为5L,得到0.2Cmol·L-1氯化钠溶液
D.同温同压时,H2和CH4两种气体的密度之比为1∶8
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH![]() 、Cl-、HS-
、Cl-、HS-
B.酸性溶液中可能大量存在Na+、CH3COO-、SO![]() 、I-
、I-
C.碱性溶液中可能大量存在Na+、K+、Cl-、AlO![]()
D.使甲基橙变黄色的溶液中可能大量存在Fe3+、K+、Cl-、SO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A.标准状况下,3.36L的氦气中含有0.6NA个中子
B.6.5gZn与足量浓H2SO4完全反应,产生气体的分子数为0.1NA
C.标准状况下,2.24L的乙酸在O2中完全燃烧,得到0.2NA个CO2分子
D.1molFe与足量稀硝酸充分反应后,转移电子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】通过实验得出的结论正确的是( )
A.用铂丝蘸取待测液放在火焰上灼烧,火焰呈黄色,则原溶液中含Na+不含K+
B.向待测液中加氯化钡溶液,生成白色沉淀,再加稀盐酸,沉淀不溶解,则原溶液中含有SO![]()
C.向待测液中加稀盐酸,生成无色无味气体,则溶液中含CO![]()
D.向待测液中加NaOH溶液,有白色沉淀生成,继续加入NaOH溶液,沉淀全部溶解,则原溶液中可能含Al3+
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用作木材的防腐剂等。用氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2 O3、FeO等)生产ZnSO4·7H2O的流程如下:
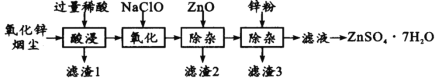
有关金属离子[c(Mn+)= 0.l mol/L]形成氢氧化物沉淀的pH范围如下表:
金属离 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 4.7 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 6.7 |
(1)“酸浸”时用的稀酸是____;滤渣1主要成分是____。
(2)“氧化”时的离子方程式为_________;加入ZnO除杂时溶液的pH控制范围是____~5.0。
(3)滤渣3含有锌和____;滤液得到ZnSO4·7H2O的操作是____、洗涤、干燥。
(4)取14.35gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 8. 95 | 8. 05 | 6. 72 | 4.05 |
则680℃时剩余固体的化学式为________(填序号)。
A.ZnO B.Zn3O(SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法生产。气相直接合成的反应为:C2H4(g)+H2O(g)![]() C2H5OH(g) ΔH,乙烯的平衡转化率随温度、压强的变化关系如下图[其中n(C2H4):n(H2O)=1︰1]。
C2H5OH(g) ΔH,乙烯的平衡转化率随温度、压强的变化关系如下图[其中n(C2H4):n(H2O)=1︰1]。
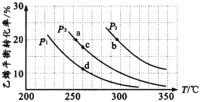
(l)P2时,若起始n(H2O)=n(C2H4)=lmol,容器体积为1L,反应经5 min达到a点,在0~5 min时段,反应速率v(C2H5OH)为____mol/(Lmin),a点的平衡常数Ka=______(保留两位小数)。
(2)乙烯气相直接水合反应的ΔH____0(填“>”或“<”),相同起始量达到a、b所需要的时间ta__tb(填“>”、“<”或“=”,后同)。c、d两点的平衡常数Kc____Kd。
(3)300℃时,要提高乙烯的平衡转化率可采取的措施有______、______ 、___。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸钠是重要的化工原料之一,广泛应用于轻工日化、建材、食品工业等行业。
(1)市售碳酸钠中含有氯化钠杂质,选用下列试剂设计实验方案进行检验,试剂:稀H2 SO4、BaCl2溶液、Ca(NO3)2溶液、AgNO3溶液
实验步骤 | 现 象 |
①取少量样品,加蒸馏水溶解 | ②固体完全溶解得到无色澄清溶液 |
③_____ | ④有白色沉淀生成 |
⑤静置,________ | ⑥ ________ |
(2)用AgNO3标准溶液滴定Cl-(以K2CrO4溶液为指示剂,Ag2CrO4为砖红色沉淀),来测定碳酸钠的纯度。
①配制样品溶液:称取某碳酸钠样品mg,用容量瓶配制100 mL溶液,定容时,用____加蒸馏水至刻度线。
②配制AgNO3溶液及浓度标定:称取AgNO3晶体8.5 g于烧杯中,用____取500 mL水并倒入烧杯中,搅拌摇匀后,转入____色试剂瓶,置于暗处、备用。用NaCl标准溶液标定上述AgNO3溶液浓度为b mol/L。
③滴定样品:取样品溶液20. 00 mL于锥形瓶中,加过量稀HNO3,滴入2~3滴K2 CrO4溶液,用AgNO3标准溶液滴定,滴定终点的现象为_________。
重复上述操作三次。四次测定数据如下表:
实验序号 | 1 | 2 | 3 | 4 |
消耗AgNO3溶液体积/mL | 20.00 | 21. 55 | 20. 02 | 19. 98 |
若在滴定终点读取滴定管刻度时俯视标准液液面,则测定结果____(填“偏高”、“偏低”或“无影响”);样品的纯度为____%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com