
科目: 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为
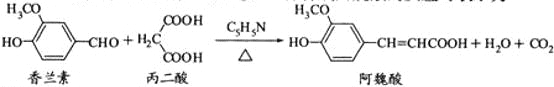
下列说法正确的是
A. 可用酸性![]() 溶液检测上述反应是否有阿魏酸生成
溶液检测上述反应是否有阿魏酸生成
B. 香兰素、阿魏酸均可与![]() 、
、![]() 溶液反应
溶液反应
C. 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D. 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种
查看答案和解析>>
科目: 来源: 题型:
【题目】“达菲”是瑞士罗氏公司研制的有效治疗人类禽流感的药物。达菲的主要合成原料是我国盛产的莽草酸。


下列说法不正确的是( )
A.莽草酸可溶于水
B.1 mol莽草酸最多可和4 molNaOH溶液反应
C.从结构上推测,达菲既可与盐酸反应又可与氢氧化钠溶液反应
D.从结构上推测,以莽草酸为原料合成达菲须经过酯化反应等步骤
查看答案和解析>>
科目: 来源: 题型:
【题目】NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下:
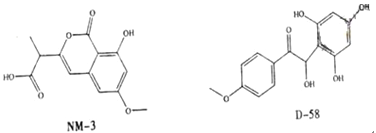
关于NM-3和D-58的叙述,错误的是
A.都能与![]() 溶液反应,原因不完全相同
溶液反应,原因不完全相同
B.都能与溴水反应,原因不完全相同
C.都不能发生消去反应,原因相同
D.遇![]() 溶液都显色,原因相同
溶液都显色,原因相同
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )
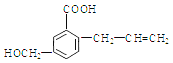
A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
科目: 来源: 题型:
【题目】下列与有机化合物结构、性质相关的叙述错误的是
A.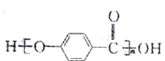 的结构中含有酯基
的结构中含有酯基
B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解
C.甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同
D.苯不能因化学反应而使溴的四氯化碳溶液退色;说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物I是一种治疗霍奇金病、慢性淋巴细胞性白血病等疾病的药物,其一种合成路线如下:
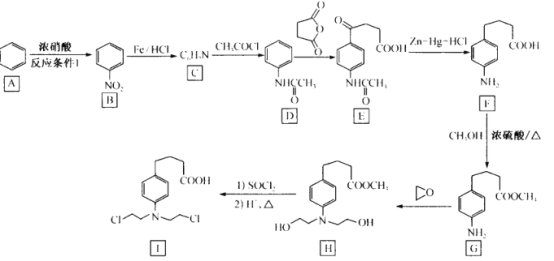
回答下列问题:
(1)反应条件l 是____________________。
(2)G中官能团的名称为_________;C的结构简式为____;B→C的反应类型_____。
(3)写出F→G 的化学力程式:_____________。
(4)W是F的同分异构体,写出满足下列条件的W的结构简式:____(不考虑立体异构,只需写出三种)。
①芳香族化合物,既能发生银镜反应又能发生水解反应
②核磁共振氢谱显示有5组峰,且峰面积之比为6:2:2:2:1
(5)设计由苯 和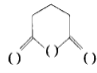 为主要原料制备
为主要原料制备 的合成路线: ___(其他无机试剂任选)。
的合成路线: ___(其他无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
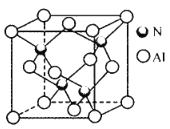
【题目】金属氮化物具有高熔点、高硬度、高化学稳定性以及良好的导热、导电性,目前已经广泛应用于磁学、电子工业 、耐高温结构陶瓷等领域 。回答下列问题
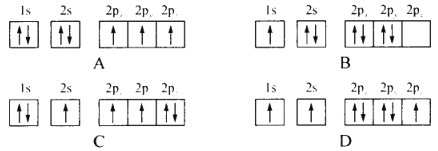
(1)下列不同状态的氮原子其能量最高的是________(填字母),基态氮原子处于最高能级的电子其电子云轮廓图形状为________
(2)第一电离能I1(N)______(填“> ”“< ”或“=”)I1(P),其原因是_____________。
(3)A和B两种金属的含氮化合物的结构如图所示:
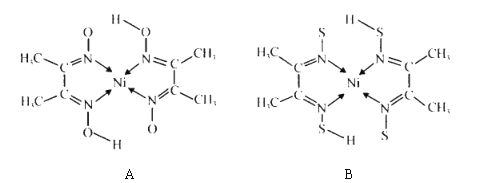
①基态 Ni 原子的核外电子排布式为[ Ar]________________。
②物质A 中碳原子的杂化方式为__________________。
③A的熔点高于 B 的,具主要原因是_______。
④B中含有的化学键类型有_____________(填字母)。
a.金属键 b. σ建
c.π键 d. 配位键
(4)氮化铝晶胞如图所示。氮原子的配位数为_______,每个铝原子周围紧邻__________个铝原子;已知立方氮化铝晶体密度为ρg cm-3,晶胞中最近的两个铝原子之间的距离为___pm(列出计算式即可,阿伏加德罗常数为6. 02×1023mol -1)。
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2是空气污染物 ,含有SO2 的尾气需处理后才能排放,有多种方法可除 去尾气中SO2。回答下列问题:
(1)氨水吸收法。利用氨水吸收烟气中的SO2, 其相关反应的主要热化学方程式如下:
SO2(g)+NH 3 H2O(aq)=NH4HSO3(aq) △H1=akJmol-1;
NH 3 H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(1)△H2= b kJ mol-1;
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4 (aq)△H3 =ckJ mol-1;
则反应 2SO2(g)+4 NH 3 H2O(aq)+ O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=___________kJ mol-1(用含a、b、c的代数式表示)。
(2)热解气还原法。已知CO与SO2 在加热和催化剂作用 下生成生成S(g)和CO2。
①该反应的化学方程式为__________。
②在T °C时,向lL恒容的密闭容器中入充1 mol CO、0.5molSO2发生上述反应(S为气态).5min时达到化学平衡,平衡时测得SO2的转化率为90 %,则 0 ~ 5 mi n 内 反应的平均速率v(SO2)=__________。此温度下该反应的平衡常数 K1=_______。下列选项中能够说明该反应已经达到平衡状态的是_____(填字母)。
a.体系的压强保持不变
b.混合气体的密度保持不变
c.混合气体的平均摩尔质量保持不变
d.单位时间内CO消耗的物质的量与 SO2 生成的物质的量之比为2:1
(3)氧化锌吸收法。配制ZnO悬浊液(含少量 MgO、CaO)在吸收塔中封闭循环脱硫。发生的主要反应为ZnO十SO2 = ZnSO3(s).吸收过程中,测得pH、吸收效率η随 时间t的变化如图a所示。溶液中含硫元素微粒各组分浓度之比如图b所示。
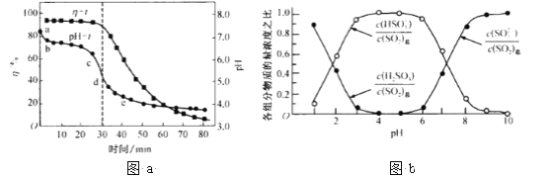
①已知纯ZnO的悬浮液 pH 约为6.8,判断在pH-t曲线cd 段发生的主要反应的离子方程式为____________。
②SO2的吸收效率η随 pH 降低而减小的原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。某同学以含铜废料(主要成分是 CuO、MgO、MnO、SiO2及少量的杂质)为主要原料制备CuCl的主要流程如下:
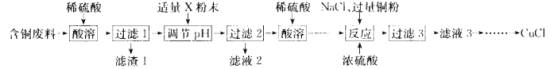
已知:①CuCl难溶于水和乙醇 ,在潮湿的空气中易被氧化;
②在水溶液中存在平衡 :CuCl(白色)+2Cl-![]() [CuCl3]2-(色无溶液)。
[CuCl3]2-(色无溶液)。
③几种金属氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | 开始沉淀的 pH | 完全沉淀的 pH |
Mg(OH)2 | 8. 4 | 10. 8 |
Cu(OH)2 | 4.2 | 6. 7 |
Mn(OH)2 | 7. 8 | 8. 8 |
问答下列问题:
(1)滤渣1 的主要成分是 _________________(写化学式,下同)。
(2)“调pH”所用粉末状试剂 X 是_____________;pH的调节范闱为____________。
(3)“反应”发生 Cu2+ +Cu+6Cl-=2[CuCl3]2-,表明已完全反应的现象是_______________。
(4)向“滤液3” 加大量的水,过滤可得 CuCl。所得沉淀需再用乙醇洗涤.并在低温下干燥,其原因是___________。
(5)产品纯度的测定,步骤如下:称取mg试样置于锥形瓶中,加入直径 4 ~ 5 mm 玻璃珠适量,并加入 10 mL FeCl3溶液,摇动至样品全部溶解后(CuCl+FeCl3=CuCl2+FeCl2),再加入50 mL,水和2滴邻菲罗啉指示剂,立刻用c mol L-1 的硫酸高铈[Ce(SO4)2]标准溶液滴定(Fe2++Ce4+=Fe3++Ce3+)'滴至终点时共消耗硫酸高铈标准溶液V mL。
①锥形瓶中加入玻璃珠的作用是____________________。
②样品中 CuCl 的质量分数为_____(列出表达式即可 , 用含(c、m、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com