
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
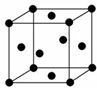 甲烷、甲醇、肼(N2H4)、氨和氢气等都可作为燃料电池的燃料.
甲烷、甲醇、肼(N2H4)、氨和氢气等都可作为燃料电池的燃料.查看答案和解析>>
科目: 来源: 题型:
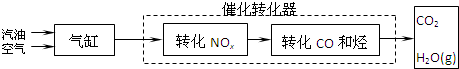
| ||
| △ |
| ||
| △ |
| b-2a |
| 2 |
| b-a |
| 2 |
| b-2a |
| 2 |
| b-a |
| 2 |
查看答案和解析>>
科目: 来源: 题型:

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4?7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4?FeSO4?6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
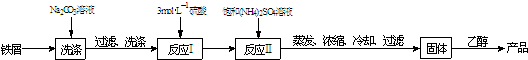
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com