
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
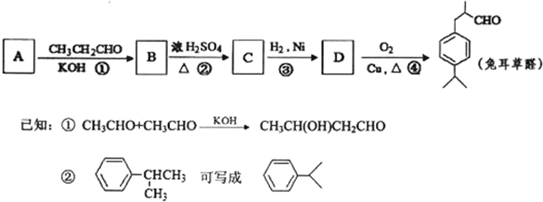
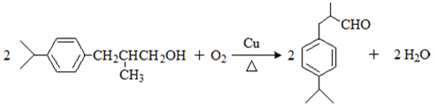
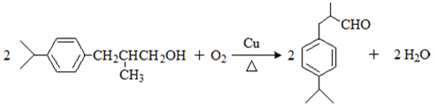
查看答案和解析>>
科目: 来源: 题型:阅读理解
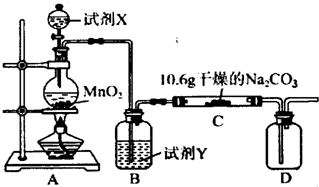
| ||
| ||
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. |
 |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a. a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3: 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 |
b. 若溶液变浑浊,证明固体中含有NaCl 若溶液变浑浊,证明固体中含有NaCl |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 通电 |
| 一定条件 |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |

查看答案和解析>>
科目: 来源: 题型:
2- 7 |
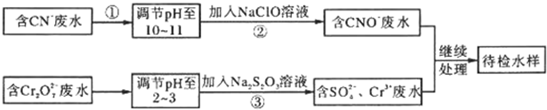
| S2O | 2- 3 |
2- 7 |
| SO | 2- 4 |
2- 7 |
查看答案和解析>>
科目: 来源: 题型:
(2013?日照一模)常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(
|
查看答案和解析>>
科目: 来源: 题型:
 (2013?日照一模)用气体传感器可以检测汽车尾气中CO的含量.传感器是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质
(2013?日照一模)用气体传感器可以检测汽车尾气中CO的含量.传感器是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com