
科目: 来源: 题型:
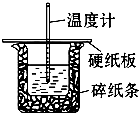 某学生实验小组用50mL 0.50mol?L-1的盐酸与50mL 0.50mol?L-1的NaOH溶液在图所示的装置中进行中和反应反应热的测定.
某学生实验小组用50mL 0.50mol?L-1的盐酸与50mL 0.50mol?L-1的NaOH溶液在图所示的装置中进行中和反应反应热的测定.查看答案和解析>>
科目: 来源: 题型:
 mA(气)+nB(气)?pC(气)+qD(气) 的 C% 与时间 t 有如图关系
mA(气)+nB(气)?pC(气)+qD(气) 的 C% 与时间 t 有如图关系查看答案和解析>>
科目: 来源: 题型:
| 压强(kPa) | 13.33 | 53.32 | 101.3 |
| K的沸点(℃) | 590 | 710 | 770 |
| Na的沸点(℃) | 700 | 830 | 890 |
| KCl的沸点(℃) | 1437 | ||
| NaCl的沸点(℃) | 1465 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 高温 |
| c3(H2O) |
| c3(H2) |
| c3(H2O) |
| c3(H2) |
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
| 1400℃ |
| 约3000℃ |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com