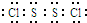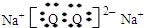S
2Cl
2是工业上常用的硫化剂,有非常广泛的应用.实验室制备S
2Cl
2的反应原理有两种:
①CS
2+3Cl
2CCl
4+S
2Cl
2;
②2S+Cl
2S
2Cl
2.
已知:S
2Cl
2易与水反应;下表是几种物质的熔沸点:
| 物质 |
S |
CS2 |
CCl4 |
S2Cl2 |
| 沸点/℃ |
445 |
47 |
77 |
137 |
| 熔点/℃ |
113 |
-109 |
-23 |
-77 |
(1)如图中尾气处理装置不够完善,请你提出改进意见
在D和E之间增加干燥装置
在D和E之间增加干燥装置
.利用改进后的正确装置(部分夹持仪器已略去)进行实验,反应原理是
①
①
(填写题目中反应原理的数字序号).
(2)A中反应的离子方程式是
MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
;C中盛放的试剂是
浓硫酸
浓硫酸
.
(3)反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是
蒸馏
蒸馏
.
(4)S
2Cl
2分子中各原子最外层均满足8电子稳定结构,该分子的电子式是
.
(5)S
2Cl
2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,该反应的化学方程式是
2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑
2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑
.

 S2Cl2是工业上常用的硫化剂,有非常广泛的应用.实验室制备S2Cl2的反应原理有两种:
S2Cl2是工业上常用的硫化剂,有非常广泛的应用.实验室制备S2Cl2的反应原理有两种: