
科目: 来源: 题型:阅读理解

| 物理性质 | 乙酸 | 乙醇 | 1-丁醇 | 乙酸乙酯 | 乙酸丁酯 |
| 熔点(℃) | 16.6 | -117.3 | -89.5 | -83.6 | -73.5 |
| 沸点(℃) | 117.9 | 78.5 | 117 | 77.06 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.79 | 0.81 | 0.90 | 0.88 |

查看答案和解析>>
科目: 来源: 题型:
 H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1| [H2]?[CO2] |
| [CO]?[H2O] |
| C(H2)C(CO) |
| C(H2O) |
| C(H2)C(CO) |
| C(H2O) |
 H2+CO2
H2+CO2 H2+CO2
H2+CO2| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
| 元素 | 元素性质及相关信息 |
| A | 其单质的一种晶体虽不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可作高温轴承的润滑剂、火箭发动机喷管和电极材料. |
| B | 其单质能与强酸、强碱溶液反应,其离子在第三周期单核阳离子中半径最小. |
| C | 是蛋白质的组成元素之一,原子核外有3种不同能量的电子,且未成对电子数最多. |
| D | 原子核外最外层电子排布为nsnnp2n+1. |
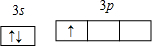

 NH 3?H2O
NH 3?H2O NH4++OH-
NH4++OH- NH 3?H2O
NH 3?H2O NH4++OH-
NH4++OH-查看答案和解析>>
科目: 来源: 题型:
(2008?闵行区模拟)一定质量的某硝酸钾样品中不含可溶性杂质,在10℃时加一定量蒸馏水使之充分溶解,残留固体的质量为250g,若升温至40℃,残留固体的质量为120g;升温至70℃,残留固体的质量为20g.已知KNO3在不同温度下的溶解度:
|
查看答案和解析>>
科目: 来源: 题型:
(2008?闵行区模拟)某学生设计了如下除去某物质中杂质的方法:
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com