(2013?德州模拟)钠及其化合物具有广泛的用途.
(1)工业上可利用反应Na(l)+KCl(l)?K(g)+NaCl(l)来治炼金属钾,此反应利用了钠的还原性及
金属钠的沸点高于金属钾的沸点
金属钠的沸点高于金属钾的沸点
,写出钠与TiCl
4反应冶炼Ti的化学方程式
.
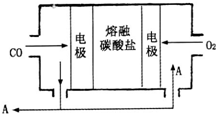
(2)用Na
2CO
3熔融盐作电解质,CO、O
2为原料组成的新型电池的研究取得了重大突破.该电池示意图如右:负极电极反应式为
2CO-4e-+2CO32-=4CO2
2CO-4e-+2CO32-=4CO2
,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为
CO2
CO2
.
(3)常温下,浓度均为0.1mol?L
-1的下列五种钠盐溶液的pH如下表;
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
上述盐溶液中的阴离子,结合H
+能力最强的是
CO32-
CO32-
,根据表中数据,浓度均为0.01mol?L
-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是
C
C
(填编号).
A.HCN B.HClO C.CH
3COOH D.H
2CO
3(4)实验室中常用NaOH来进行洗气和提纯.当300mL 1mol?L
-1的NaOH溶液吸收标准状况下4.48LCO
2时,所得溶液中各离子浓度由大到小的顺序为
C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+)
C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+)
.
(5)几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu
2+、Mg
2+、Fe
2+离子的溶液中滴加NaOH溶液时,
Cu2+
Cu2+
(填离子符号)先沉淀,K
SP[(Fe(OH)
2]
<
<
K
SP[(Mg(OH)
2](填“>”、“=”或“<”).

 (2013?德州模拟)钠及其化合物具有广泛的用途.
(2013?德州模拟)钠及其化合物具有广泛的用途.