
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
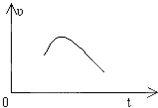 把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的主要因素是( )
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的主要因素是( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| NaOH溶液 |
| 酸化 |
| NaOH溶液 |
| 酸化 |
| NaOH溶液 |
| 酸化 |


| 实验步骤 | 所用试剂 | 现 象 | 结 论 |
| 1 | |||
| 2 | |||
| 3 | |||
| 4 |
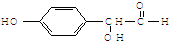

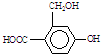 为实现以下物质的转化
为实现以下物质的转化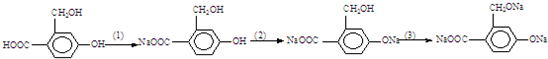
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
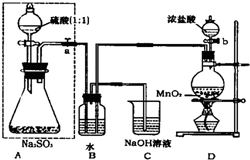 长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了如图实验:请回答下面的问题:
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了如图实验:请回答下面的问题:
| ||
| ||
| 126b |
| 233a |
| 126b |
| 233a |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com