
科目: 来源: 题型:
2 1 |
3 1 |
4 2 |
1 0 |
查看答案和解析>>
科目: 来源: 题型:
美国《时代》周刊曾评选出十大科学发现,“潜在的新元素”榜上有名.这种元素暂时被命名为117号元素,元素符号为Up.在俄罗斯杜布纳实验室里,用
|
查看答案和解析>>
科目: 来源: 题型:

| ||
| ||
查看答案和解析>>
科目: 来源: 题型:阅读理解
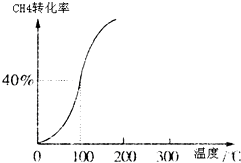 Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
Ⅰ、合成氨对农业生产及国防建设均具有重要意义.| 1 | 2 |

查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com